SCI论文解读(8):FGF2调控SPRY1表达在食管癌浸润的耗竭型T细胞中的作用及机制研究
发布单位: 广东省医学会医学科研实验室建设与管理学分会 / 阅读:2163 次 / 2021/4/20 7:51:06
 陈青云,广东省人民医院医学研究部助理研究员,博士毕业于香港大学李嘉诚医学院青少年与儿科学系免疫学专业,博士后任职于中山大学肿瘤防治中心华南肿瘤学国家重点实验室。主要从事自身免疫疾病,抗病毒免疫,肿瘤的免疫逃逸机制与免疫靶向治疗等方面的研究。2017年获得广东省博士后人才引进海外青年博士后引进项目资助。近年来获得国家自然科学基金青年项目,博士后基金面上项目的资助,以第一/共一作者在Cancer Research, Journal of Autoimmunity, Frontiers in Immunology和Journal of Immunology等杂志发表SCI学术论文6篇。
陈青云,广东省人民医院医学研究部助理研究员,博士毕业于香港大学李嘉诚医学院青少年与儿科学系免疫学专业,博士后任职于中山大学肿瘤防治中心华南肿瘤学国家重点实验室。主要从事自身免疫疾病,抗病毒免疫,肿瘤的免疫逃逸机制与免疫靶向治疗等方面的研究。2017年获得广东省博士后人才引进海外青年博士后引进项目资助。近年来获得国家自然科学基金青年项目,博士后基金面上项目的资助,以第一/共一作者在Cancer Research, Journal of Autoimmunity, Frontiers in Immunology和Journal of Immunology等杂志发表SCI学术论文6篇。

1.引言
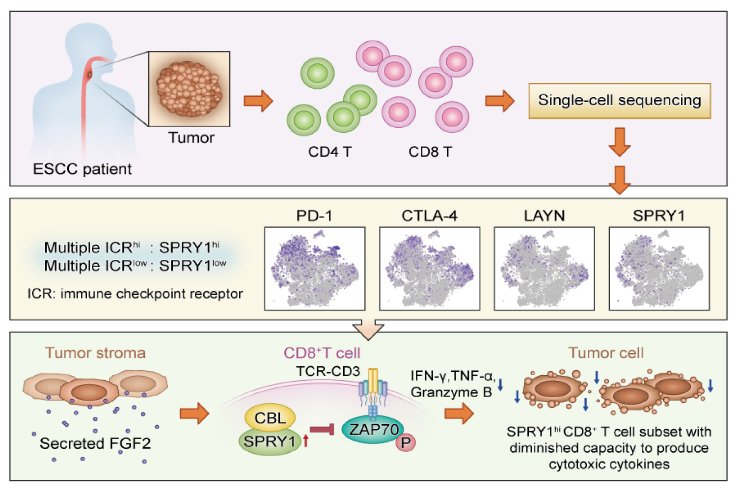
食管癌是比较常见的消化道恶性肿瘤,在世界恶性肿瘤中居第6位,全世界每年约有30万人死于食管癌。我国是食管鳞状细胞癌(简称食管癌)的高发国家,占全世界病例总数的一半。经完成和正在进行的食管癌免疫治疗的临床试验肯定了免疫治疗在食管癌治疗中的潜力。因此,开展免疫治疗相关研究对食管癌治疗特别是晚期食管癌的治疗具有重要的临床意义。作者通过对食管癌病人肿瘤部位浸润的T淋巴细胞进行单细胞测序,明确了食管癌浸润T细胞的亚群。作者发现了3组CD8+T细胞高表达免疫检查点分子,如PD-1, CTLA-4, Tim-3, 和LAYN等。因此作者定义这3群细胞为耗竭型T细胞。并且,这3组耗竭型T细胞具有非常高的异质性,体现在其富集的信号通路具有很大的差异。除了已知的免疫检查点基因外,作者发现SPRY1在其中两群耗竭型CD8+T细胞中特异性上调。SPRY1最早作为果蝇成纤维细胞生长因子(FGF)受体信号转导的抑制分子被研究,其主要通过抑制Ras-MAPK途径来调控FGF信号通路。而SPRY1在CD8+T细胞中的作用,特别是其调控T细胞在肿瘤免疫中的作用还知之甚少。
2. 结果展示
(1)作者鉴定出了12个CD8+T细胞亚群和4个CD4+T细胞亚群。其中,3个T细胞亚群CD8_C1-EOMES, CD8_C7-PRDM1和CD8_C8-SPRY1均高表达免疫抑制检查点基因,如PDCD1, CTLA4, HAVCR2, LAG3, EOMES和LAYN,因此,这三群细胞是耗竭型T细胞(TEX)。值得注意的是,这些耗竭型T细胞并不完全失去功能,它们仍然高表达效应分子,如IFNG, GZMB和PRF1。其他CD8+T细胞,例如CD8_C2-ZNF683, 高表达组织驻留记忆T细胞(TRM)标记基因,例如ITGAE和CXCR6,代表富集的TRM细胞。CD8_C4-KLRG1细胞的特征是效应记忆T细胞标记物(如KLRG1,GZMK,LYAR和EOMES)的高表达,而IL-7R(CD127)的表达却很低,代表了KLRG1hiIL7Rlow的效应型记忆T细胞(TEM)。 CD8_C11-IL7R细胞高表达记忆T细胞标志基因,如IL7R和LYAR,并且这群细胞中KLRG1的表达要比CD8_C4-KLRG1细胞低得多,提示这群细胞是具有KLRG1lowIL7Rhi特征的记忆前体细胞,能够产生长期存活的记忆T细胞。 CD8_C12-FGFBP2细胞高表达TBX21,CX3CR1,GNLY和PRF1,提示这群细胞是具有细胞毒性效应功能的T细胞。 CD8_C9-CCR7高表达高核糖体亚基转录本,并特异性表达初始细胞标记基因,例如SELL和CCR7,提示这群细胞是初始T细胞。 CD8_C3-KLF2与CD8_C9-CCR7共同高表达CCR7,SELL和IL7R,而JUNB,FOSB,TCF7和KLF2在CD8_C3-KLF2中表达更高,表明CD8_C3-KLF2是中央型记忆T细胞(TCM)。CD8_C14-IFIT1高表达干扰素诱导基因,包括IFIT1,IFIT3,IFI44L,IFI6和ISG15。CD8_C15-MKI67高表达STMN1,PCLAF,PCNA和MKI67,这些标志基因与有丝分裂密切相关。
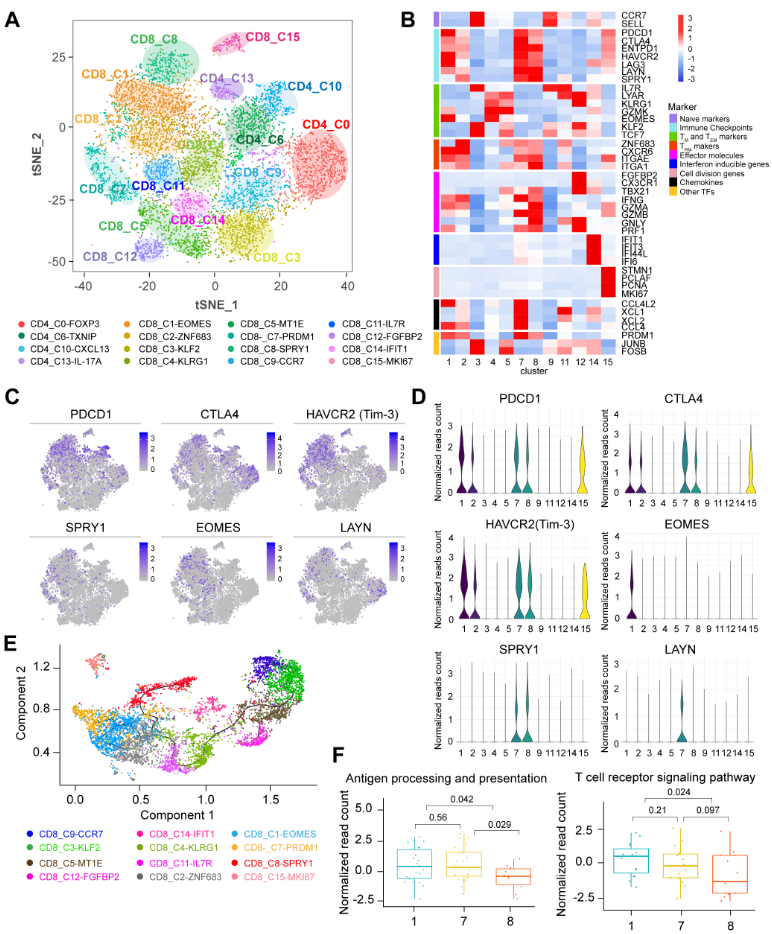
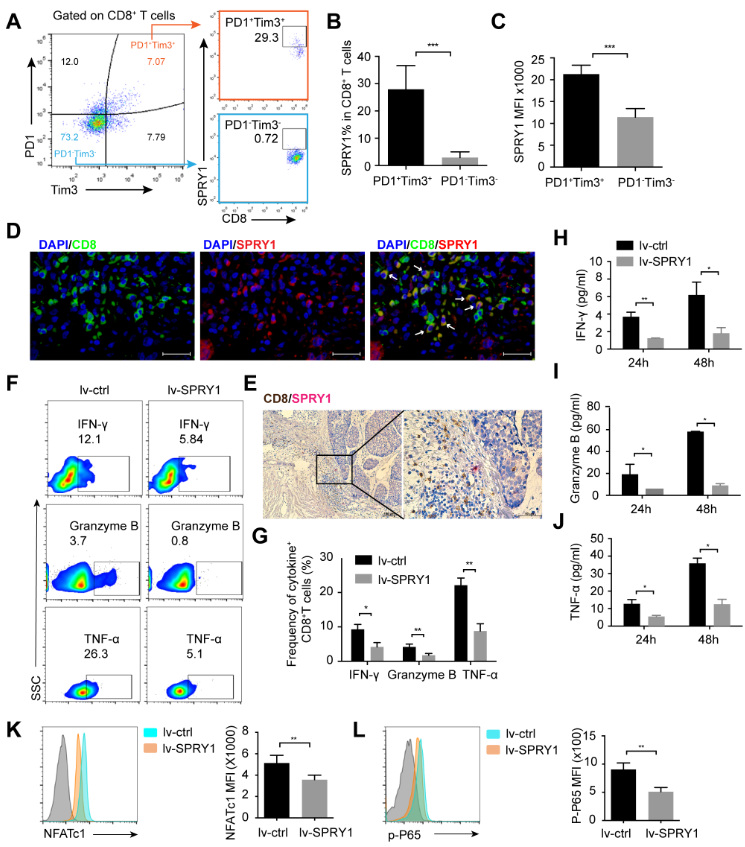
(2)SPRY1在CD8_C7-PRDM1和CD8_C8-SPRY1 TEX细胞中表现出特异性的表达模式。 SPRY1最初在果蝇气管发育过程中作为果蝇成纤维细胞生长因子受体信号转导的抑制因子被发现。目前,关于SPRY1与肿瘤浸润的CD8+T细胞的关系还未有研究。作者通过流式细胞术染色发现,相对于PD-1-Tim-3-CD8 +T细胞,耗竭型的PD-1+ Tim-3+ CD8+T细胞高表达SPRY1表达。食管肿瘤组织切片的免疫荧光(IF)和免疫组织化学(IHC)染色,验证了SPRY1在肿瘤浸润CD8+T细胞上的表达。SPRY1过表达显著抑制CD8+ T细胞分泌IFN-γ,Granzyme-B和TNF-α。在T细胞受体(TCR)刺激后,SPRY1的过表达也降低了NFATc1的表达和P65的磷酸化。这些数据支持SPRY1能够抑制TCR触发下CD8+T细胞的激活。
(3)为了进一步探讨SPRY1抑制TCR活化信号的机制,作者在Jurkat细胞中过表达或敲除SPRY1,并用抗CD3 / CD38抗体对其进行了激活。SPRY1的过表达抑制了TCR诱导的ZAP70,LAT和SLP-76磷酸化。相反,在SPRY1敲除后,TCR刺激导致ZAP70,LAT,SLP-76发生更强的磷酸化。这些数据表明SPRY1是TCR信号下游的抑制基因。接着,使用抗SPRY1抗体对SPRY1进行免疫沉淀可以拉下内源性CBL和ZAP-70。 CBL是在TCR刺激下最早发生酪氨酸磷酸化的白质之一,并且它充当ZAP-70酪氨酸磷酸化的负调节基因。作者推测SPRY1通过影响CBL与ZAP-70的结合从而调控TCR激活信号。然而, SPRY1的过度表达或敲除并没有影响CBL和ZAP-70之间的相互结合。但是,SPRY1过表达能够下调ZAP-70磷酸化。相反,SPRY1缺乏会上调抗CBL抗体免疫沉淀细胞裂解物中的ZAP-70磷酸化。并且,在CBL缺失的情况下,SPRY1对TCR信号转导起到完全相反的作用,这表明SPRY1介导的TCR信号转导的抑制依赖于CBL。

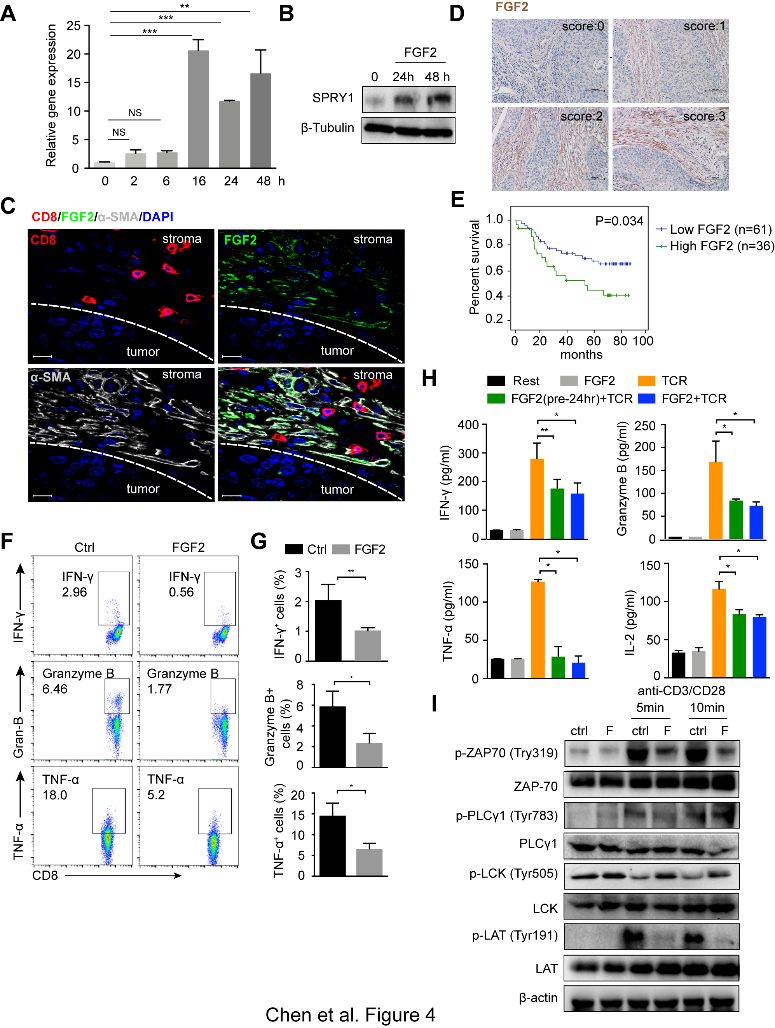
(4)接下来,作者想探索CD8+ TEX细胞中SPRY1上调的机制。由于SPRY1是FGF信号传导的已知拮抗基因,并且通过肿瘤免疫估计资源(TIMER)鉴定了SPRY1和FGF2表达之间的显著正相关性。 通过western blot, 作者发现FGF2显著上调SPRY1的mRNA和蛋白水平。多色免疫荧光染色表明,FGF2主要由ESCC肿瘤基质中的α-SMA+成纤维细胞表达,而浸润的CD8+ T细胞可以与肿瘤基质中表达FGF2的α-SMA+成纤维细胞紧密接触。通过对来自97名ESCC患者肿瘤组织进行IHC染色发现,免疫组化评分表明低FGF2表达的病人具有更好的总体存活率。通过进行胞内染色,作者发现FGF2预处理CD8+ T细胞中24小时后,再加抗CD3 / CD28刺激,IFN-γ,Granzyme-B和TNF-α的分泌量相对没有FGF2处理组显著降低。通过检测有无FGF2时TCR刺激CD8+ T细胞上清液中IFN-γ,Granzyme-B,TNF-α和IL-2的分泌,作者得到了相同的结果。此外,FGF2预处理后,再给抗CD3/CD28抗体激活可显著降低ZAP-70,LAT磷酸化并增强LCK Try505磷酸化。 此外,FGF2预处理还降低了CD8+ T细胞中NFATc1的表达和P65磷酸化。这些数据表明FGF2可以抑制TCR触发的T细胞激活,进而在抗肿瘤免疫反应中起负向调控作用。
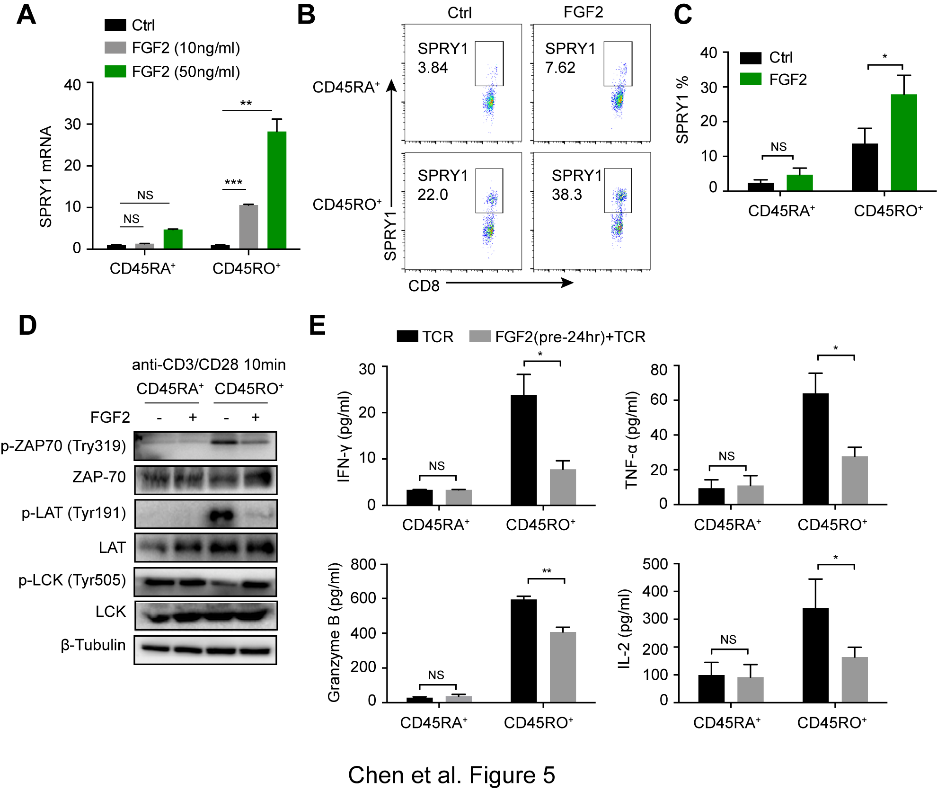
(5)FGF2通过与表面受体酪氨酸激酶FGF受体(FGFRs)1和2结合而发挥其活性。与CD45RA+CD8+T细胞相比,FGF2显著诱导CD45RO+CD8+T细表达SPRY1和FGFR1。此外,在相同培养条件下,FGF2预处理仅下调CD45RO+CD8+记忆T细胞中ZAP-70,LAT,ERK和Src磷酸化,而对CD45RA+CD8+初始T细胞未有影响。同样,在TCR刺激后,FGF2显着降低了CD45RO+CD8+T细胞产生的IFN-γ,Granzyme-B,TNF-α和IL-2的产生。
 3.总结
3.总结
综上所述,通过对8,000多个食管癌浸润T细胞的单细胞测序,作者清楚地描述了ESCC肿瘤浸润的T细胞分群。SPRY1主要在耗竭型CD8+T细胞中表达。SPRY1的大量表达削弱了TCR信号通路激活和细胞因子的产生。进而降低了T细胞的抗肿瘤功能。SPRY1调控TCR信号的机制在于其能够结合CBL蛋白,促进CBL负向调控ZAP-70磷酸化。基于TCGA数据库分析,作者发现食管癌肿瘤组织中SPRY1与FGF2的表达具有显著正相关性。免疫组化证实了食管癌肿瘤微环境中存在大量分泌FGF2的成纤维细胞,并且FGF2在肿瘤组织中的表达量与病人的预后呈显著负相关。接下来,作者验证了FGF2可以促进原代CD8+T细胞表达SPRY1,并负向调控TCR活化。因此,肿瘤微环境中的成纤维细胞通过分泌FGF2诱导SPRY1的高表达,进而参与促进T细胞耗竭。
原文链接:https://cancerres.aacrjournals.org/content/early/2020/10/22/0008-5472.CAN-20-1542 (IF=9.727)
特别鸣谢:
本文转自:GD省医公共实验室公众号:

欢迎投稿:MLCMGD@163.com


