SCI论文解读(13):核受体TLX转录激活PD-L1促进胶质瘤免疫抑制微环境
发布单位: 广东省医学会医学科研实验室建设与管理学分会 / 阅读:2564 次 / 2021/6/28 7:44:29
 吴丁兰,南方医科大学深圳医院副研究员,临床医学创新中心副主任,博士后合作导师,深圳市海外高层次“孔雀计划”人才,香港中文大学博士、博士后,研究方向为核受体与肿瘤发生、抗肿瘤治疗靶点和肿瘤免疫微环境机制和转化医学研究。目前已发表SCI论文近30篇,第一作者或通讯作者论文发表在Journal for Immunotherapy of Cancer、Oncogene、J Pathology、BBA Reviews on Cancer等肿瘤学前沿杂志。主持国自然面上、深圳市科技计划学科布局重点项目等多项科研项目。学术任职包括中国研究型医院学会病毒肿瘤学专委会常委、秘书长,深圳市医学会实验医学专委会常委等。
吴丁兰,南方医科大学深圳医院副研究员,临床医学创新中心副主任,博士后合作导师,深圳市海外高层次“孔雀计划”人才,香港中文大学博士、博士后,研究方向为核受体与肿瘤发生、抗肿瘤治疗靶点和肿瘤免疫微环境机制和转化医学研究。目前已发表SCI论文近30篇,第一作者或通讯作者论文发表在Journal for Immunotherapy of Cancer、Oncogene、J Pathology、BBA Reviews on Cancer等肿瘤学前沿杂志。主持国自然面上、深圳市科技计划学科布局重点项目等多项科研项目。学术任职包括中国研究型医院学会病毒肿瘤学专委会常委、秘书长,深圳市医学会实验医学专委会常委等。

1. 引言
核受体(Nuclear receptor)家族是国际公认的药物靶标。核受体功能的异常与癌症、代谢性疾病等多种疾病的发生发展具有直接关系。据统计,在现有临床药物中,核受体靶向药物占全球医药市场的10-15%。在抗肿瘤领域,核受体靶向药物在癌症的治疗中取得巨大成功,如雌激素受体靶向药物他莫昔芬、雄激素受体靶向药物恩杂鲁胺等。因此,针对核受体发掘肿瘤新靶点将为抗肿瘤创新药物研发提供新的源头,对研发具有自主知识产权创新药物具有积极意义。
胶质瘤是颅内高发肿瘤,高级别胶质瘤恶性程度高、易复发且预后不良,胶质母细胞瘤(GBM)五年平均生存期低于 5%。近年来,免疫治疗在恶性胶质瘤上做了非常积极的探索,如免疫监测点抑制,CAR-T细胞治疗和疫苗等,但胶质瘤特殊的免疫抑制微环境对免疫治疗造成很大的挑战。因此,探究胶质瘤的免疫微环境调控机制对改善其免疫治疗疗效至关重要。已有报导显示GBM组织表达PD-L1,为胶质瘤免疫检测点PD-1/PD-L1治疗提供了理论基础。针对PD-1/PD-L1靶点的一系列临床研究也显示单抗治疗对复发GBM的临床获益有限,但仍是有希望的方向。研究PD-L1在肿瘤细胞中的调控机制对提高PD-1/PD-L1的治疗效果和改善耐药具有重要意义。然而,胶质瘤细胞表面PD-L1的水平如何受到调节,其表达如何进一步影响肿瘤控制和预测治疗反应,目前尚不清楚。因此,探究导致PD-1单抗治疗无应答的免疫逃逸分子机制、研发提高患者应答率的新治疗方法至关重要。
南方医科大学深圳医院临床医学创新中心吴丁兰团队在免疫治疗前沿杂志The Journal for Immunotherapy of Cancer (IF=10.252)上发表题为Orphan nuclear receptor TLX promotes immunosuppression via its transcriptional activation of PD-L1 in glioma 论文。该研究首次揭示了孤儿核受体TLX在胶质瘤免疫微环境调控中的重要功能,阐明了TLX转录激活PD-L1的分子机制,提出了TLX拮抗剂联合PD-1抗体抑制胶质瘤的新策略,为恶性胶质瘤联合免疫治疗提供了新方向。该研究是由临床医学创新中心吴丁兰副研究员、李欣研究员团队,神经外科毛捷教授团队以及病理科裴小娟教授团队合作完成。
2. 结果展示
1)TLX与PD-L1的表达水平与胶质瘤免疫抑制表型、不良预后相关。
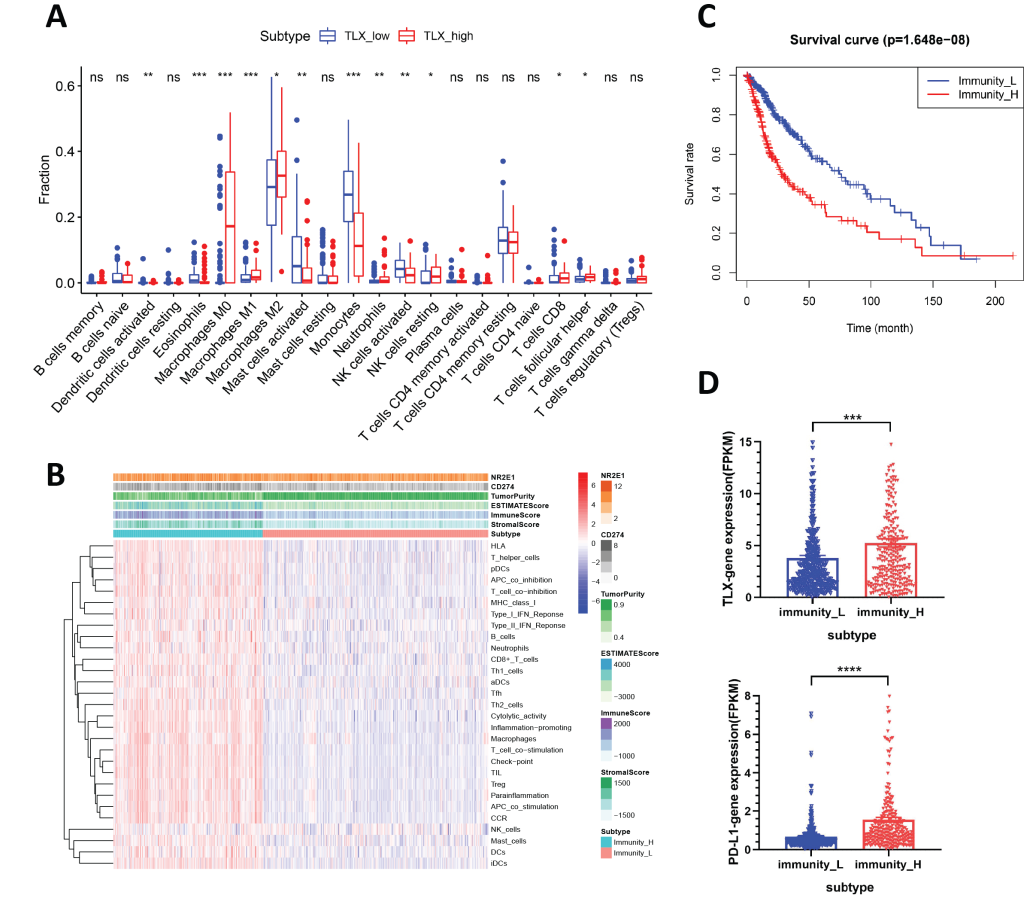
为了解TLX与PD-L1是否与胶质瘤免疫微环境存在相关性,作者使用CIBERSORT与ssGSEA两种分析方法分析公共数据库中胶质瘤的免疫微环境。通过CIBERSORT算法,获得了187例胶质瘤22种白细胞亚型的免疫矩阵,按TLX表达将其分成TLX_low与TLX_high两组,发现肿瘤相关巨噬细胞M0与M2均在TLX_high的病例中浸润增加,而单核细胞浸润减少,CD8+ T细胞、TFH细胞也浸润增加(图A)。TLX表达增加可能导致了胶质瘤免疫抑制微环境的产生。同时,运用ssGSEA方法获得每个胶质瘤样本的免疫矩阵(基于29个免疫相关基因集)。通过聚类分析将其分为两个亚群——高免疫组与低免疫组(Immunity_H与Immunity_L)(图B)。生存分析显示高免疫组与不良预后相关(图C),所以我们推测胶质瘤主要浸润免疫抑制相关细胞,造成肿瘤免疫逃逸进而促进肿瘤的恶性进展。此外在Immunity_H组中TLX与PD-L1表达量增加(图D)。综上所述,高表达TLX与胶质瘤免疫抑制微环境和不良预后有关。
2)TLX表达与胶质瘤临床分子表型、PD-L1表达、CD163+ M2型巨噬细胞浸润具有相关性。
为了了解胶质瘤TLX表达的临床相关性,作者从在线数据库TCGA与CGGA中下载胶质瘤转录组数据与临床资料。TLX的表达与胶质瘤的分子表型存在明显相关性,IDH突变样本和1p/19q杂合性缺失的样本中,TLX表达降低(图A)。在高级别胶质瘤中,TLX与PD-L1高表达且二者呈正相关(图B、C),生存分析显示二者高表达与不良预后相关(图D)。同时,作者使用免疫组化的方法检测临床样本验证以上结论,结果是相符的,且在高级别胶质瘤中,CD163+ M2型肿瘤相关巨噬细胞浸润增加(图E、F)。

3)TLX、PD-L1在胶质瘤中的表达与TILs与TAMs在胶质瘤中的分布情况。
作者运用OPAL全景免疫荧光染色的方法,发现TLX与PD-L1在肿瘤细胞上存在共定位,而TLX与CD163不存在共定位,证明TLX主要在肿瘤细胞上表达而不在免疫细胞上表达。此外,PD-L1不仅在肿瘤细胞上表达,同时存在于CD163+TAM上。PD-1不仅会在出现在TILs上也会出现在CD163+TAM上(图A、B);且高级别胶质瘤中,TLX、PD-L1表达与CD163+TAM浸润均增加(图C),表明胶质瘤细胞上的PD-L1能与TAMs与TILs上的PD-1结合介导免疫抑制。

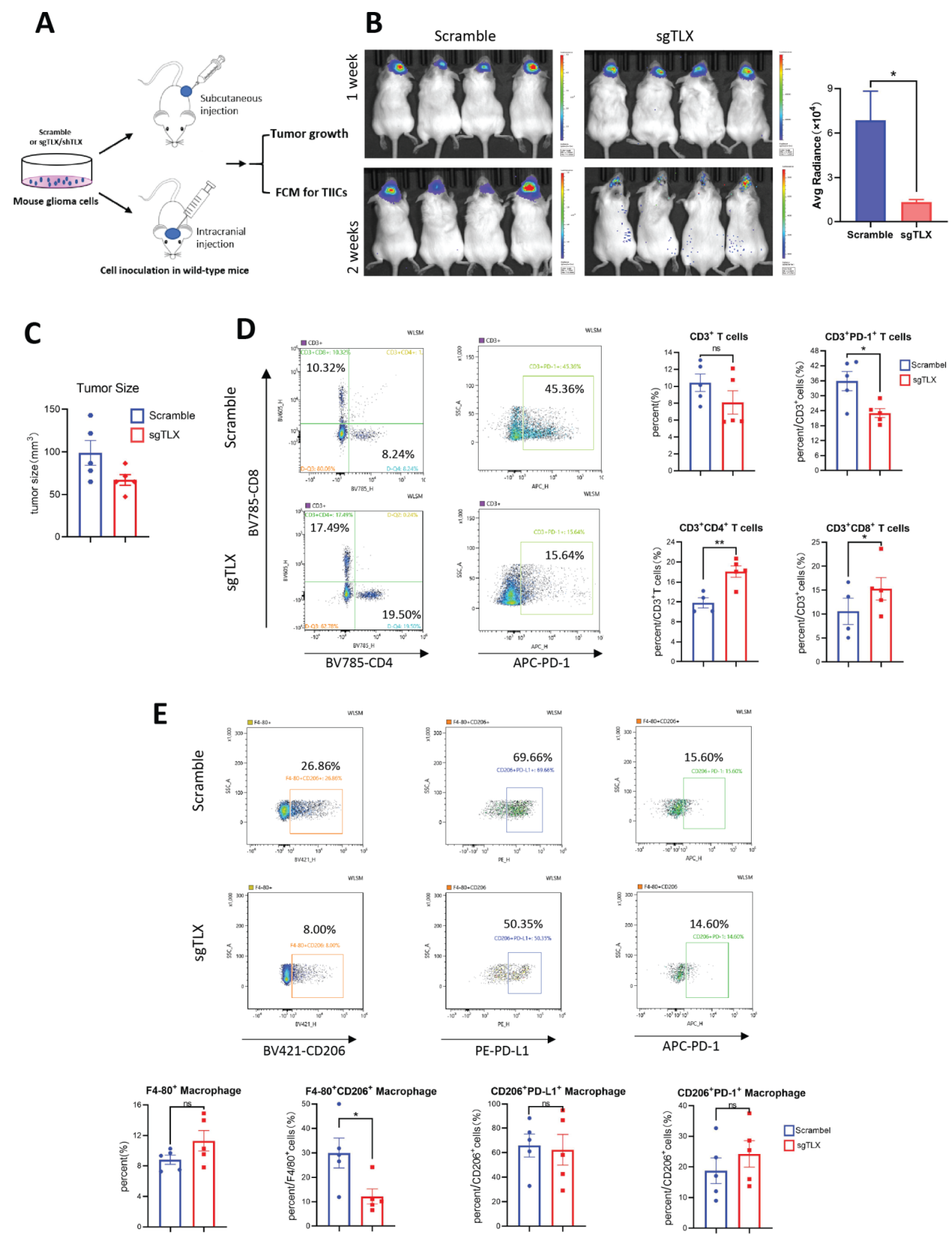
4)抑制TLX表达能通过恢复胶质瘤免疫微环境抗肿瘤活性进而抑制体内肿瘤生长。
作者将TLX敲除的鼠胶质瘤细胞皮下或颅内种植至免疫功能完善的小鼠体内,观察肿瘤生长情况并使用流式细胞术检测肿瘤免疫微环境。TLX敲除后,肿瘤生长减慢,肿瘤中浸润CD4+ T、CD8+ T细胞浸润增加,且PD-1+T细胞浸润减少;肿瘤中CD206+ M2 TAMs浸润减少,且流式检测证明胶质瘤中TAMs既能表达PD-L1也能表达PD-1。
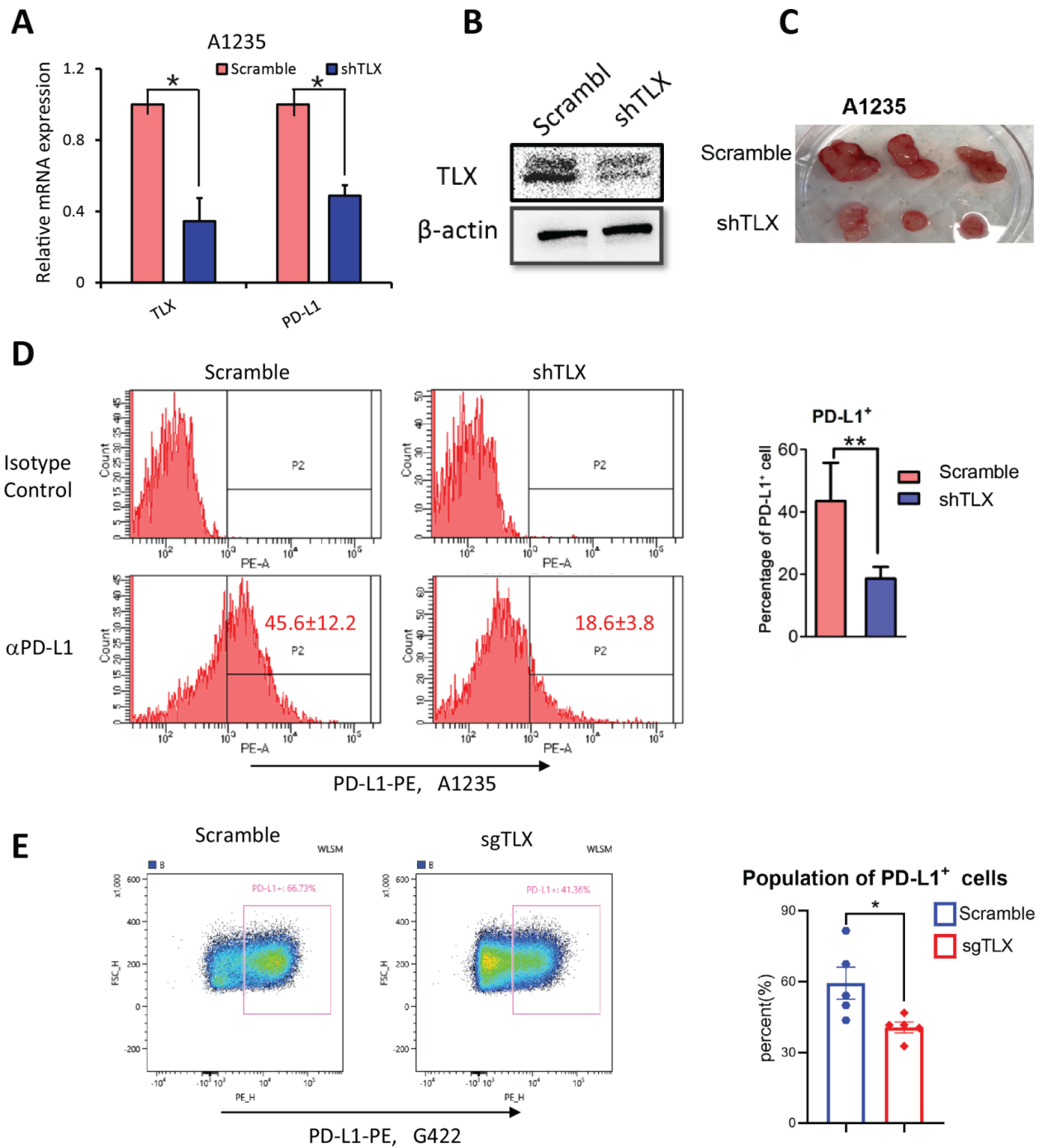
5)TLX调控胶质瘤细胞PD-L1的表达。
作者构建了TLX基因沉默的胶质瘤细胞系,mRNA水平检测显示PD-L1随TLX的降低而降低。并将上述细胞与对照细胞皮下种植到小鼠体内,抑制TLX后肿瘤生长减慢,通过流式细胞术检测肿瘤样本PD-L1表达,自体移植模型与异体移植模型均显示,抑制TLX后PD-L1+细胞减少。
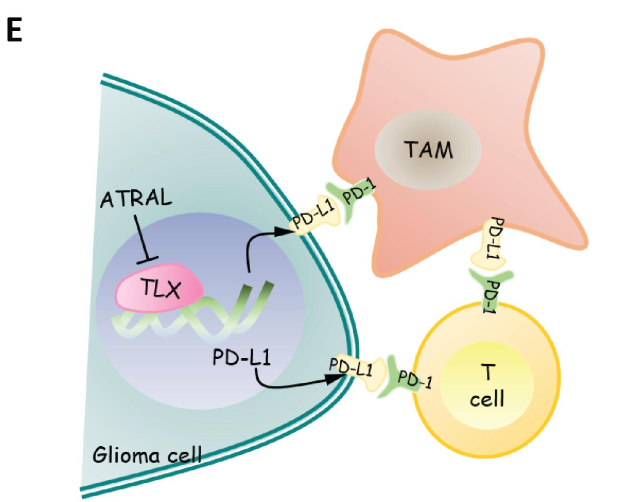
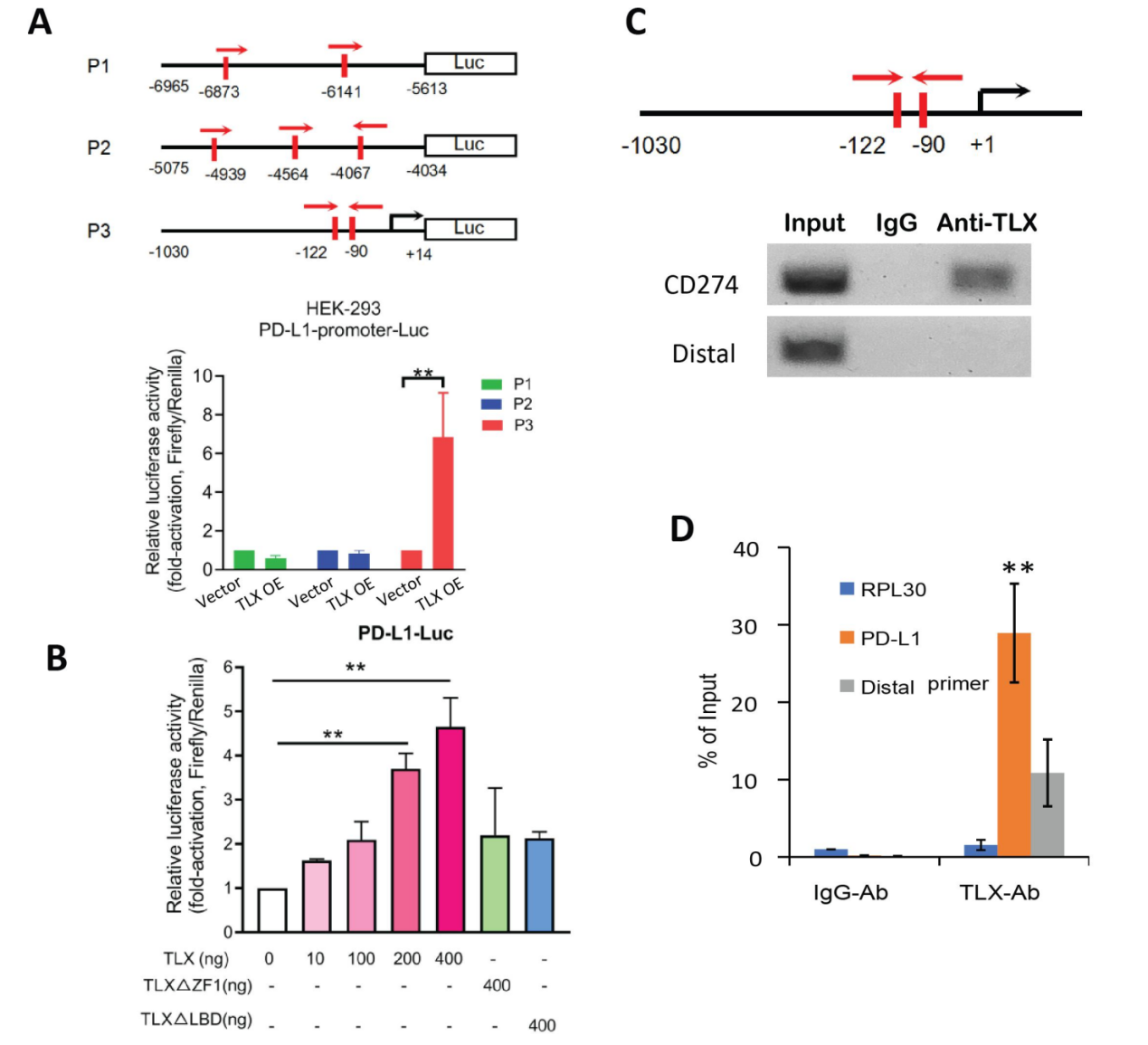
6)TLX激活CD274(PD-L1)的转录表达。作者通过双荧光素酶报告基因实验与染色体免疫共沉淀实验证实了TLX能直接调节PD-L1的转录激活。
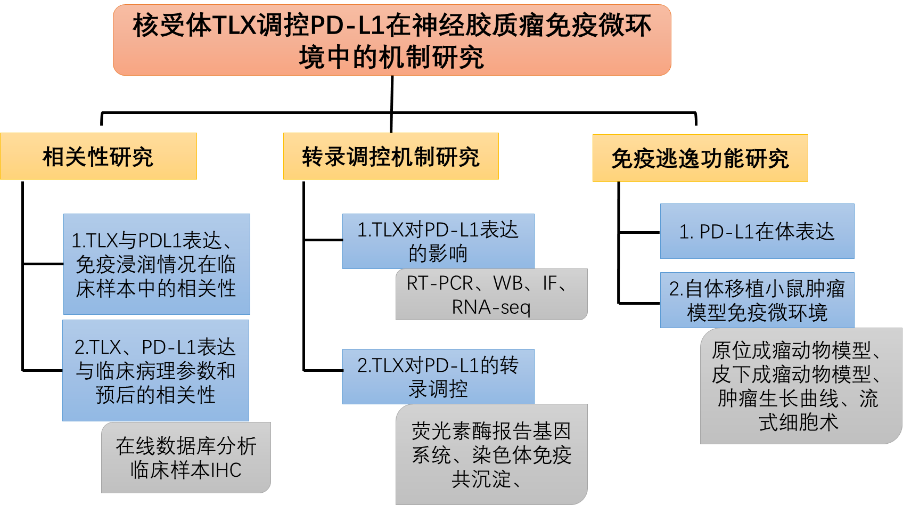
 3. 研究思路
3. 研究思路
4. 总结
本研究发现TLX能通过正向调控PD-L1的表达介导胶质瘤的免疫逃逸从而促进肿瘤的恶性进展,肿瘤细胞上的PD-L1能与TAMs与TILs上的PD-1结合介导免疫逃逸。因此,联合靶向TLX治疗可能有利于改善胶质瘤的免疫治疗效果。
原文链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8055120/ (Journal for ImmunoTherapy of Cancer,IF=10.252)
特别鸣谢:

欢迎投稿:MLCMGD@163.com


