SCI论文解读(37):临床前多模型预测黑色素瘤免疫检查点抑制剂治疗疗效
发布单位: 广东省医学会医学科研实验室建设与管理学分会 / 阅读:6051 次 / 2023/3/1 8:15:51
 王海云,医学博士,瑞典卡罗琳斯卡学院博士后,研究员,广州市妇女儿童医疗中心病理科/儿科研究所副PI;毕业于中山大学肿瘤防治中心肿瘤学专业,研究方向主要为肿瘤病理与分子分型研究、肿瘤代谢、免疫与转移、基于高通量测序研究的肿瘤早筛早诊等。目前已发表学术论文45余篇,其中以(共同)第一/通讯作者发表SCI学术论文26篇。现为广东省医学会医学科研实验室建设与管理学分会青委会副主委。
王海云,医学博士,瑞典卡罗琳斯卡学院博士后,研究员,广州市妇女儿童医疗中心病理科/儿科研究所副PI;毕业于中山大学肿瘤防治中心肿瘤学专业,研究方向主要为肿瘤病理与分子分型研究、肿瘤代谢、免疫与转移、基于高通量测序研究的肿瘤早筛早诊等。目前已发表学术论文45余篇,其中以(共同)第一/通讯作者发表SCI学术论文26篇。现为广东省医学会医学科研实验室建设与管理学分会青委会副主委。

1. 引言
免疫治疗(immune checkpoint blockage, ICB)已用于转移性黑色素瘤一线治疗。CTLA-4和PD-1/PD-L1抑制剂可以显著改善患者的生存率,因此被批准以单一或联合疗法治疗多种癌症。然而,反应率不高。尽管人们为提高ICB疗效及挖掘可预测的生物标志物付出了巨大努力,但对敏感性和耐药性的机制知之甚少。预处理过的肿瘤中肿瘤突变负荷(tumor mutation burden, TMB)和新抗原负荷水平提高,会增加T细胞浸润,并且治疗诱导的炎症途径已显示出与临床获益相关,而在某些耐药患者中检测到抗原提呈和干扰素(IFN)-γ途径的改变。尽管在特定的患者队列中确定了特定的基因表达谱,但由于缺乏高质量的转录组数据的临床数据集,ICB应答的广泛预测特征仍然难以捉摸。最近,基于免疫相关基因的表达谱,例如免疫检查点、共刺激分子和T细胞功能障碍以及排斥标志物,开发出了独立的计算预测因子。但是,这些对不同患者的益处需要进一步验证。因此有必要开发可靠的免疫活性模型进行机制评估。
2. 结果展示
在C57BL/6小鼠中建立了4种黑色素瘤模型(M1-M4):携带各种临床相关的遗传特征并暴露于不同的致癌物。
对细胞系(cell lines, CL1-4)和在同基因小鼠中扩增的肿瘤片段(GEM-derived allografts, GDA1-4)进行全外显子组测序(whole-exome sequencing, WES)。分层聚类4种模型的突变谱,并与癌症基因组图谱(TCGA)皮肤黑色素瘤(SKCM)数据集比较:M1、M2为BRAF突变组,M3为三重野生型(BRAF/RAS/NF1),M4为RAS突变组。同时,将模型与TCGA SKCM分化类别比较,验证其与人类SKCM分化表型一致。

模型RNA测序(RNA-seq)显示:M3、M4中“黑色素细胞标志物”上调,M1、M2中"神经系统"和"炎症"相关基因上调。免疫组织化学(immunohistochemistry, IHC)染色检测神经嵴谱系转录因子(SOX10)、黑色素标志物多巴色素互变异构酶(DCT、TYRP1)表达,以验证模型的不同分化状态。
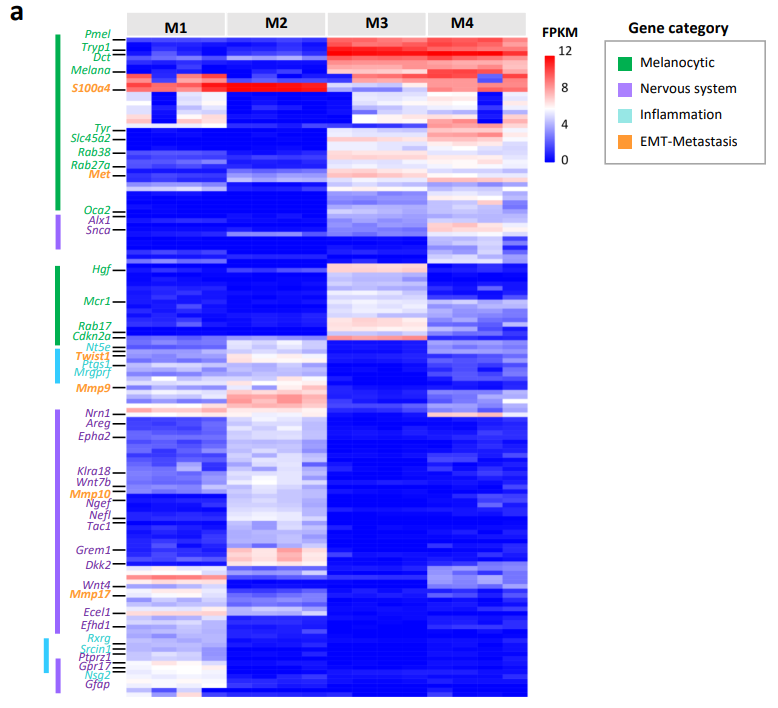

2)再现黑色素瘤患者对CTLA-4抑制剂应答的多样性
为了评估模型对ICB的应答,将GDAs或细胞系(cell line-derived allografts, CLDAs)植入C57BL/6小鼠中,并加CTLA-4抑制剂或对照处理:M1和M2,M3和M4分别成耐药性、敏感性。

鉴定黑色素瘤的免疫原性,于C57 BL/6小鼠中皮下注射γ射线照射的黑色素瘤细胞(CL1-4):显著延迟了用M3、M4细胞激发的肿瘤生长,而对M1、M2致瘤的存活率无显著影响。表明肿瘤免疫原性与CTLA-4抑制剂的应答相关。
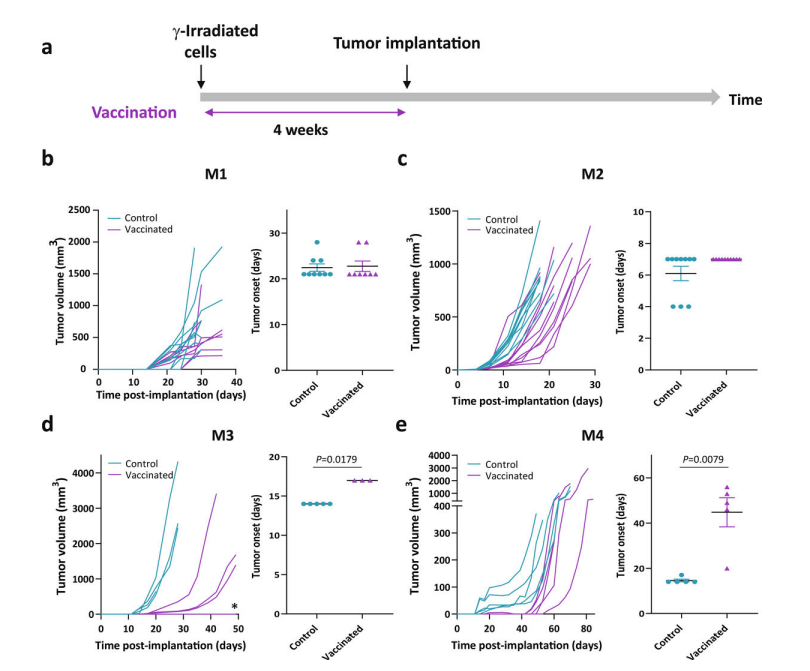
3)四种模型均具备抗原提呈功能
细胞系RT-qPCR、流式细胞术验证了主要组织相容性复合体(major histocompatibility complex,MHC)I类(H2-Kb)的表达。此外,分析未治疗或CTLA-4阻滞后的4个黑色素瘤细胞系转录组时, MHC-I和MHC-II相关基因的表达无显著差异。表明所有模型中保持了抗原呈递途径的完整性。
为了评估黑素瘤细胞在MHC-I背景下呈递抗原和活化CD 8 + T细胞的功能,将CL1-4与DCT反应性CD8+T细胞共培养,ELISA测定24小时共培养物培养基中IFN-γ浓度作为T细胞活化的读数。
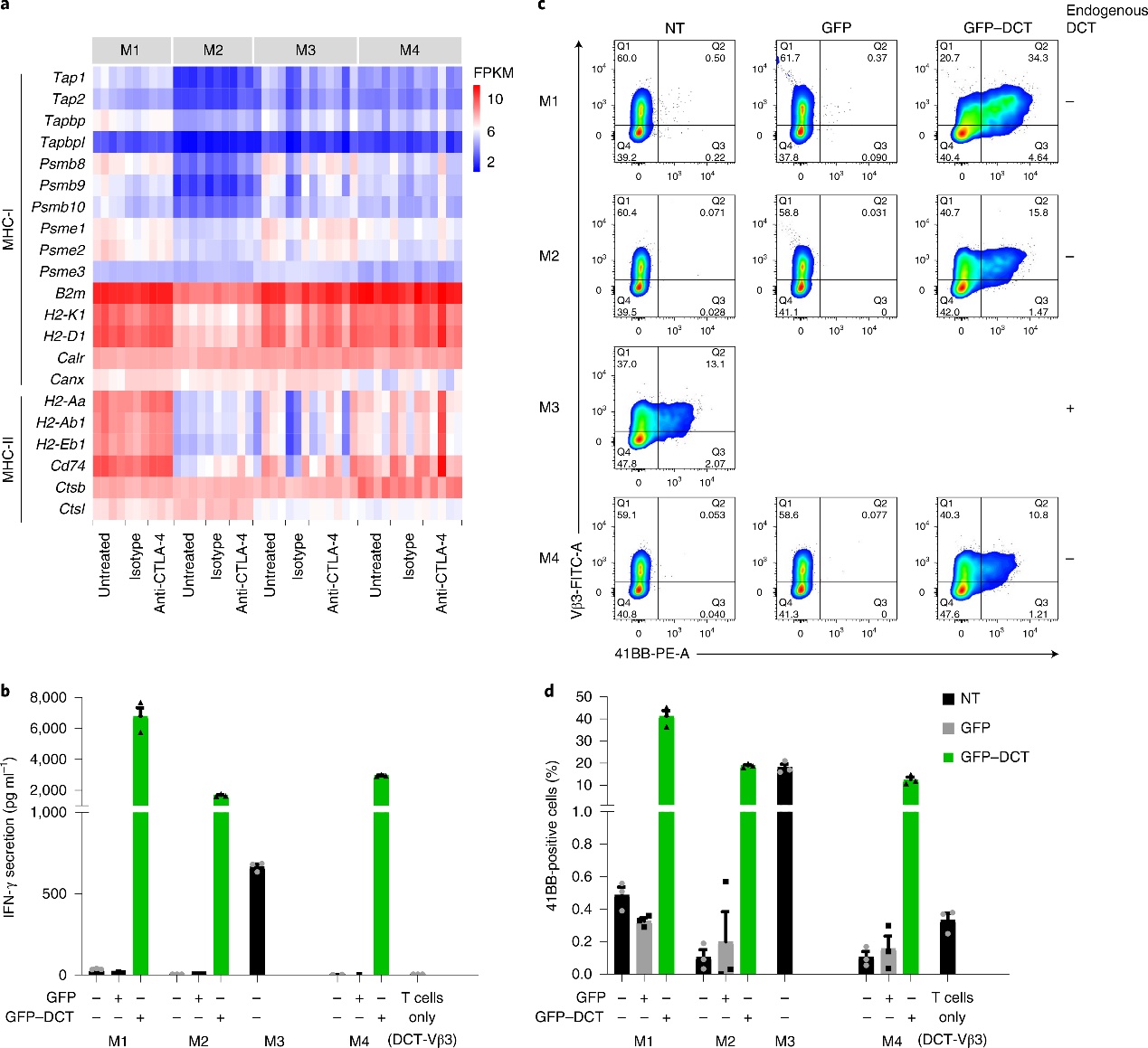
4)黑色素瘤模型中CTLA-4抑制剂的应答与瘤内免疫细胞群相关
为了评估4个模型中的肿瘤浸润淋巴细胞(TIL),对未处理的黑色素瘤进行CD 3免疫染色,耐药型M1和敏感型M4显示较高的TIL。同时,CTLA-4抑制剂处理M4后的TIL显著增加。
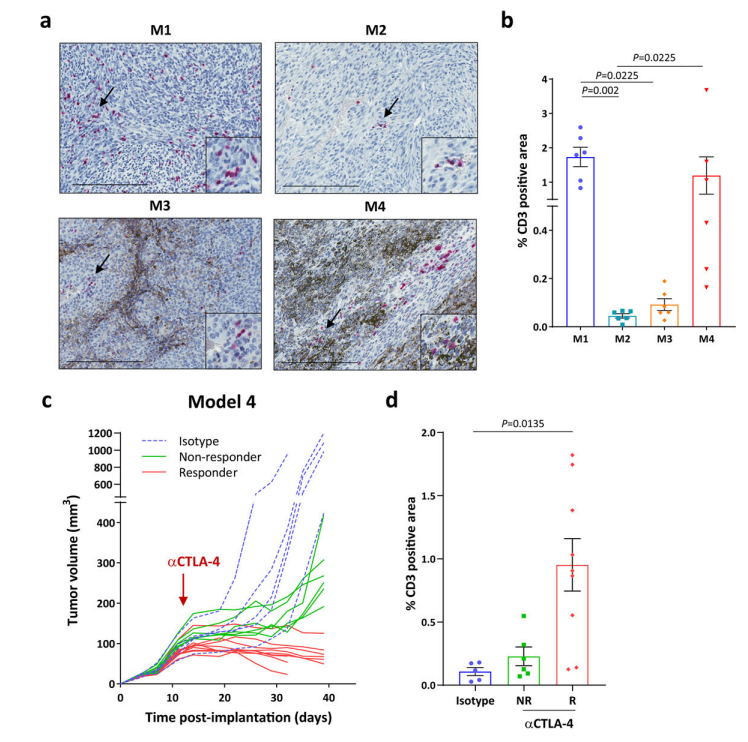
接下来,通过流式细胞术表征未予ICB治疗的模型里浸润的免疫细胞群:浸润的CD45+细胞量相近,但模型中的免疫细胞群(CD3+T、CD8+T、Tregs、CD4+T等)分布不同。揭示了模型的免疫多样性,并提示除数量之外,TIL及其他免疫细胞群的分布可能是决定ICB应答的重要因素。
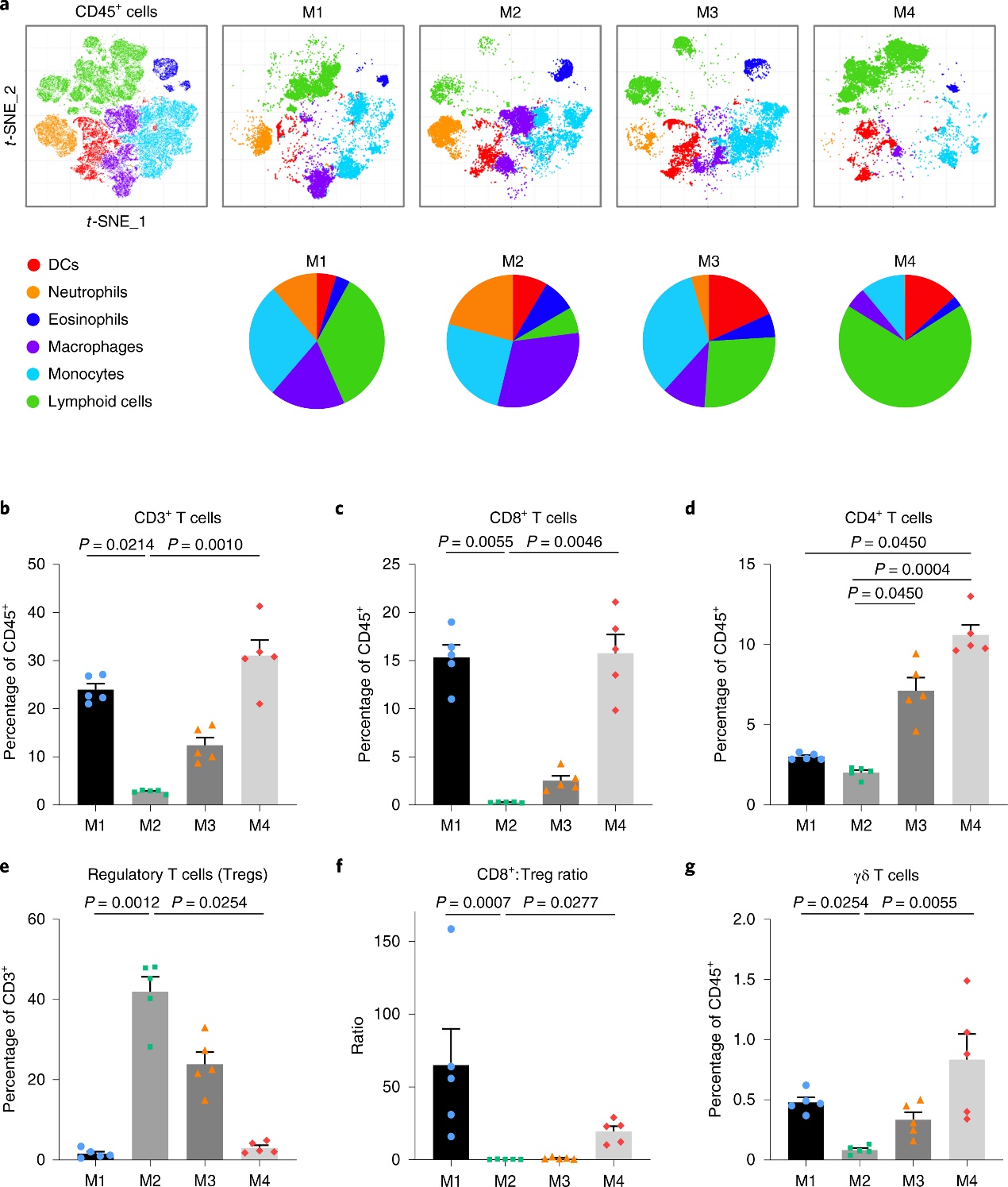
5)CTLA-4抑制剂耐药性与T细胞功能障碍或排斥相关
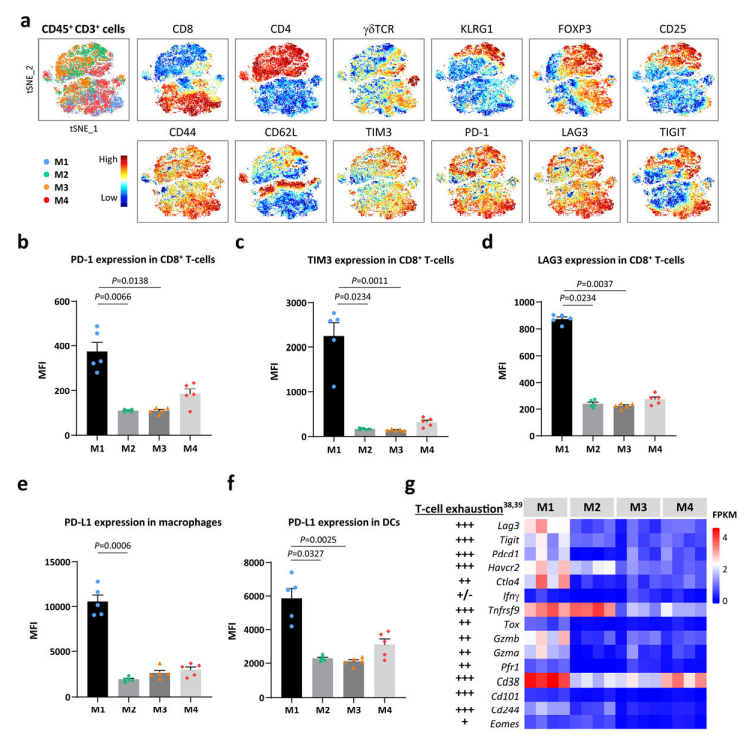
TIL丰度不足以解释模型对CTLA-4抑制剂的不同应答。为了进一步阐明免疫逃避的机制,研究者分析解读CD3 + T细胞群及耗竭标志物(PD-1、LAG3和TIM3)的表达,证实M1具有更高比例的CD8+耗竭T细胞。M1富含PD-L1+巨噬细胞、树突状细胞(dendritic cells,DCs),提示髓细胞可维持M1中T细胞耗竭。使用肿瘤免疫功能障碍和排斥(TIDE)计算方法分析了模型的RNA表达数据,M1和M2预测为“无应答者”,75%的M3和M4预测为“应答者”。此外,M1的 T细胞功能障碍评分较高,而M2的T细胞排斥反应显著。解释了M1的高TMB、TIL密度但对CTLA-4抑制剂耐药。
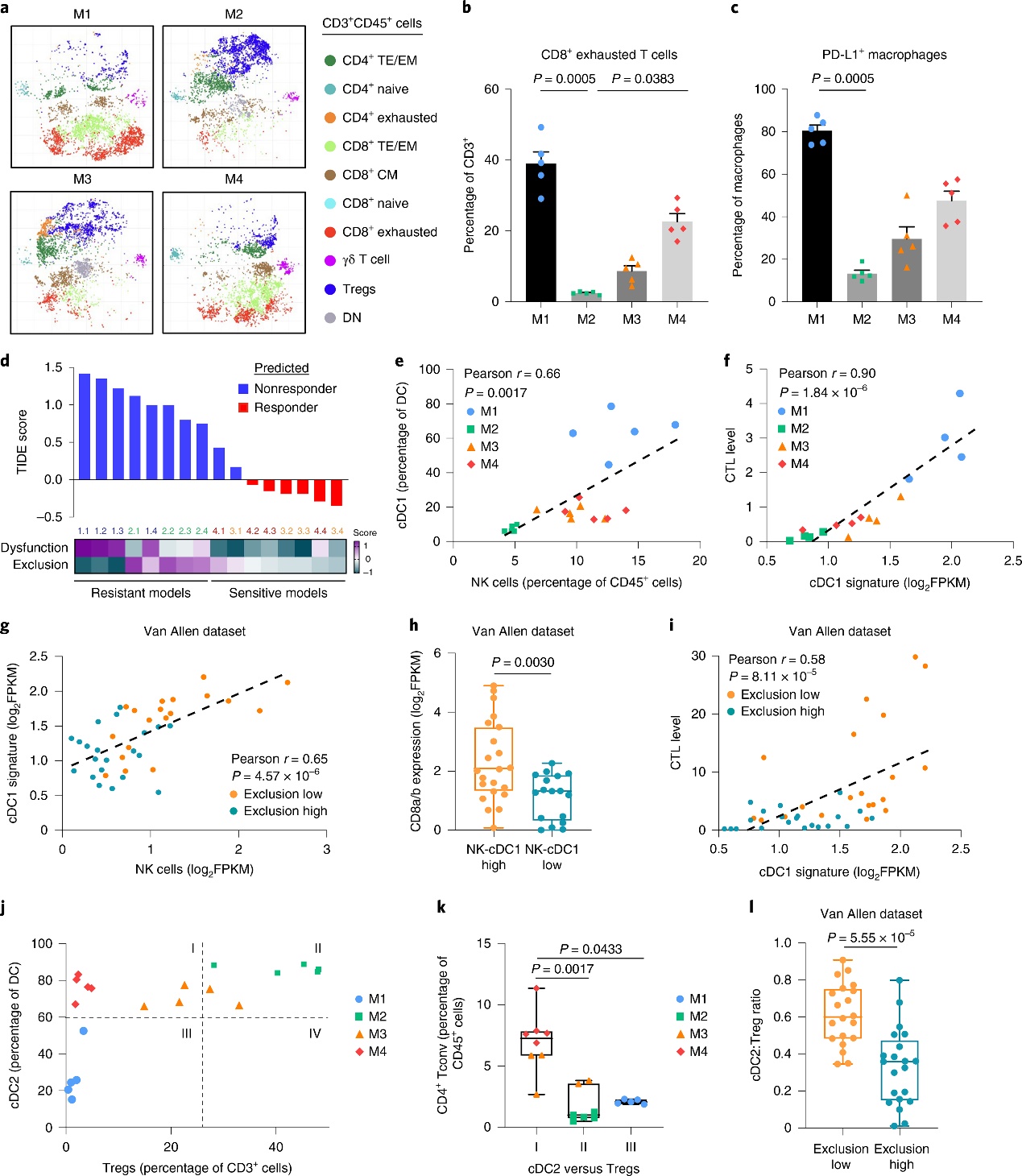
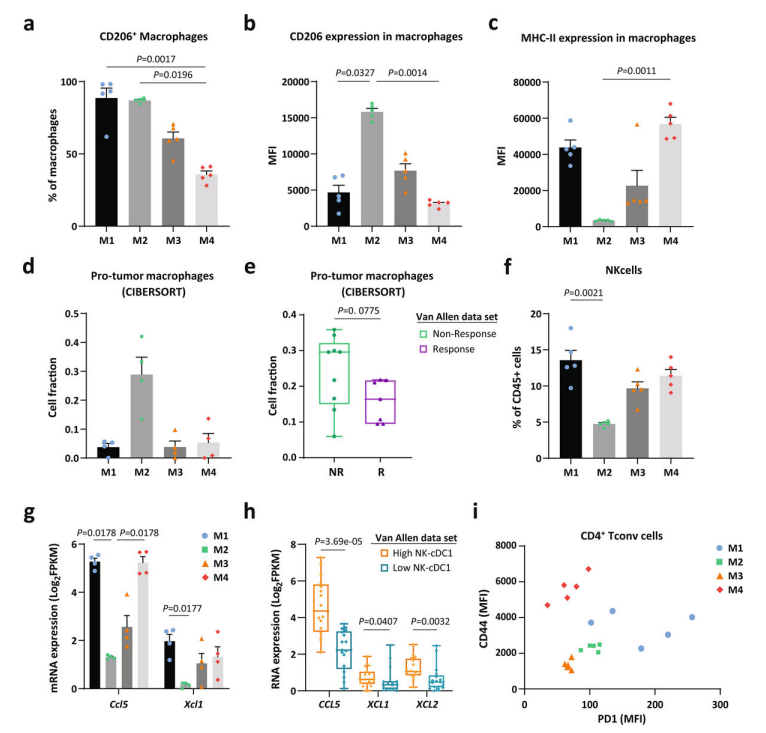
为了验证M2中T细胞排斥与耐药相关,进一步分析模型免疫细胞群,提示M1、M2不同的免疫抑制肿瘤微环境:M2中自然杀伤(natural killer, NK)细胞、cDC1、CCXL5、XCL1较少,已知CCL5和XCL1可募集cDC1诱导CD 8 + T细胞抗肿瘤反应。研究者通过RNA-seq、Van Allen数据集验证cDC1与细胞毒性T淋巴细胞(CTL)水平密切相关,NK细胞- cDC1轴的状态与CCL 5、XCL 1和XCL 2表达相关,并与CD 8a/b水平和T细胞排斥评分相关。研究者发现,M1(cDC2low/Treglow)具有与M4不同的低水平CD44(CD4+T细胞)表达,进一步证实不同模型中肿瘤免疫微环境的多样性,并提示免疫细胞的衰竭与ICB耐药相关。
6)黑色素细胞标志物可预测患者对ICB的应答
比较耐药M1、M2与敏感M3、M4转录组,寻找差异表达基因;并计算小鼠黑色素母细胞和黑色素细胞中45种基因的表达示:黑色素母细胞的特征表达与耐药M1、M2一致,而黑色素细胞与敏感M3、M4相关。具有CD34+的多能干细胞在耐药型M1、M2中的表达高于敏感型M3、M4。
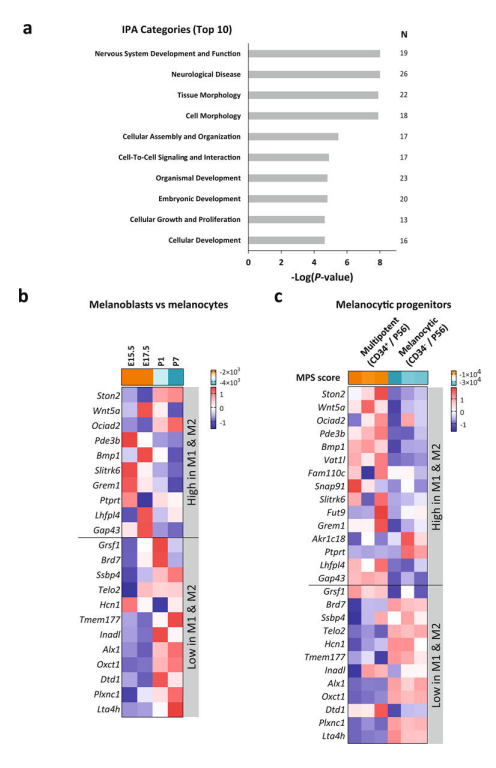
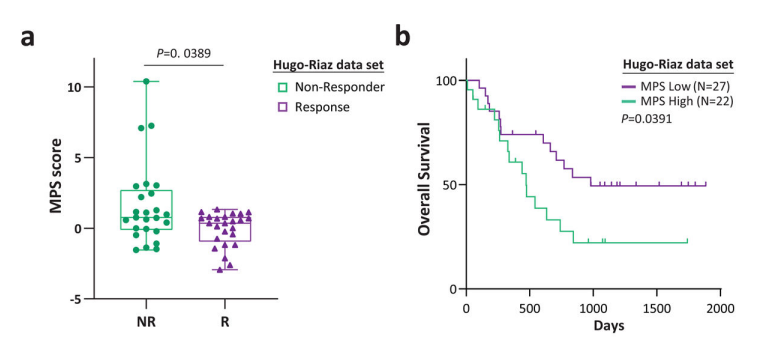
研究者将反映黑色素细胞多能分化特性的标志物称为MPS(melanocytic plasticity signature)。MPS与ICB治疗的生存分析示:MPS评分高者与较差的生存相关。

为了证实MPS评分预测ICB疗效的能力,对PD-1治疗的转移性黑色素瘤队列进行RNA-seq:敏感者MPS评分低,且总生存好。随后,用PD-1抑制剂或同型抗体作为对照处理黑色素瘤模型,与CTLA-4抑制剂的观察结果一致,M1和M2肿瘤生长和生存不受抗PD-1抗体的影响,M3表现出适度的肿瘤生长延迟,M4表现出37%的缓解率,生存期显著改善。证实MPS在预测ICB治疗患者结局方面的价值,并表明黑色素瘤的多能性和分化状态可能会广泛影响ICB的疗效。

7)MPS和TIDE综合性评分更好地预测ICB疗效
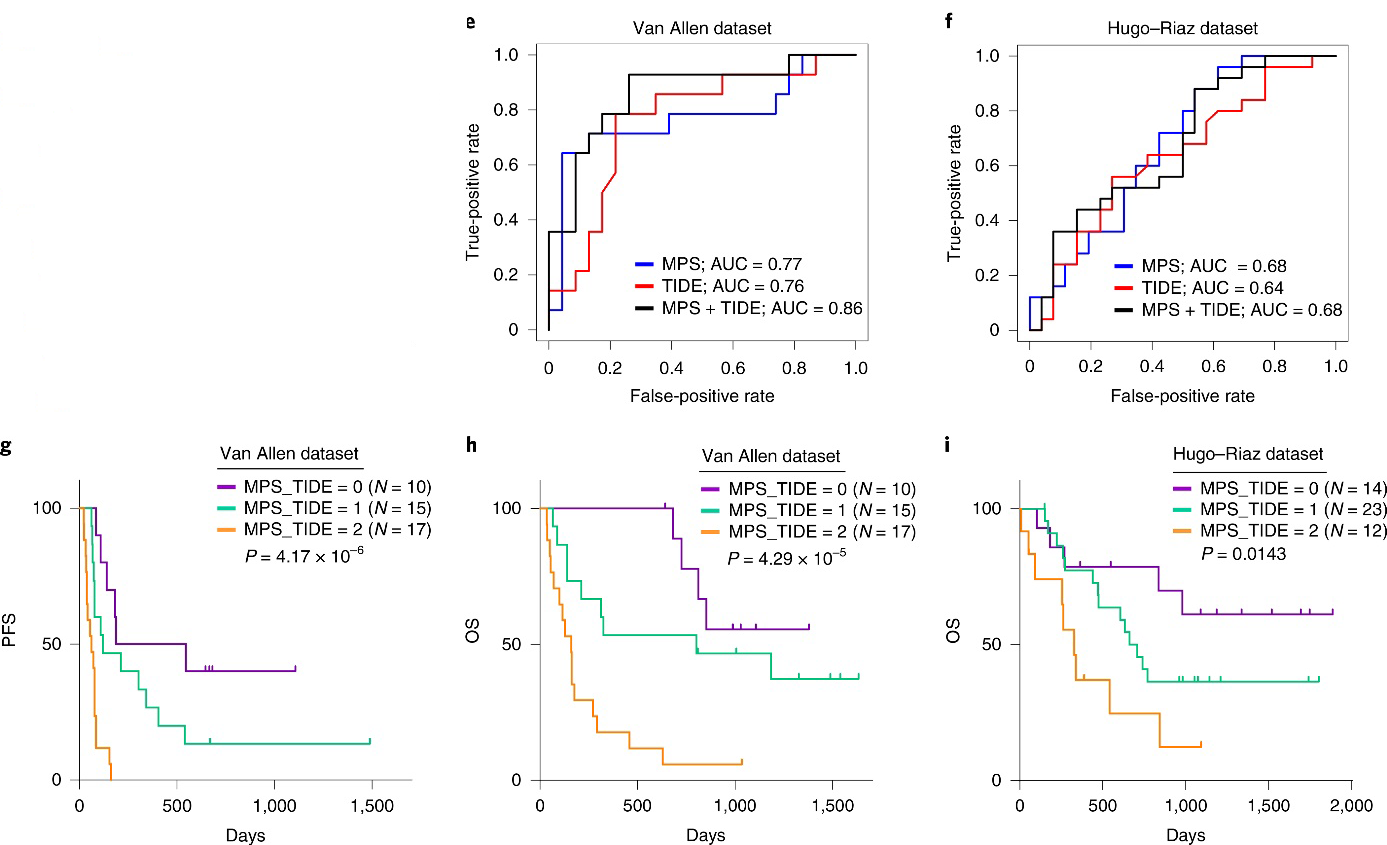
接下来,通过Van Allen和Hugo-Riaz两个数据集做受试者工作特征(receiver operating characteristic, ROC)曲线,比较MPS与PD-L1表达和TMB和TIDE方法的预测性能。

为了评估MPS和TIDE特征对生存期的潜在累加效应,研究者根据MPS和TIDE评分将每个数据集的黑色素瘤分层为3组,进行Kaplan-Meier分析,发现低MPS和低TIDE组的PFS和OS显著改善,而两个预测因子评分均较高的患者生存率最差。从而证实,肿瘤细胞内在的MPS和外在TIDE的综合分析,更有助于预测黑色素肿瘤对ICB治疗的应答。
3. 研究思路

4. 总结
该研究对四个免疫活性黑色素瘤小鼠模型进行了表征,这些模型真实地代表了人类皮肤黑色素瘤的主要分子和表型亚型,并概括了对ICB临床反应的多样性。研究分析了多个GEM来源的黑色素瘤,并加以多个数据集验证,揭示了ICB疗效的关键决定因素。对TMB、TIL密度和免疫细胞谱的分析表明模型与ICB应答的临床相关性相似,确定了T细胞功能障碍和排斥程序以及黑色素瘤分化与耐药性的强相关性,并将这两种特征结合起来可更好地预测患者对ICB的应答。此外,生成了丰富的基因组和转录组小鼠数据集,为发现预测性生物标志物提供了平台。
原文链接:https://pubmed.ncbi.nlm.nih.gov/32284588/(Nature Medicine, IF=87.241)


