SCI论文解读(16):低表达miR-34c-3p外泌体通过上调整合素α2β1促进非小细胞肺癌的侵袭和转移
发布单位: 广东省医学会医学科研实验室建设与管理学分会 / 阅读:1888 次 / 2021/8/9 7:47:18
 蔡轶,广州医科大学药学院,副研究员,硕士生导师,2012年毕业于中山大学获得博士学位。曾在美国加州大学洛杉矶分校和新加坡国立大学进行访问学者研究工作。主要研究方向为心血管药理学和中药药理学,目前以第一作者或通讯作者身份发表SCI论文14篇。
蔡轶,广州医科大学药学院,副研究员,硕士生导师,2012年毕业于中山大学获得博士学位。曾在美国加州大学洛杉矶分校和新加坡国立大学进行访问学者研究工作。主要研究方向为心血管药理学和中药药理学,目前以第一作者或通讯作者身份发表SCI论文14篇。
1. 引言
众所周知,肺癌在世界范围内造成了大量与癌症相关的死亡。虽然在诊断和治疗方面都有了很大的进步,但肺癌的死亡率仍然很高。肺癌的5年生存率低于15%。肺癌通常分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)。了解NSCLC发生发展的分子机制有助于判断预后和开发新的治疗靶点。外泌体是由内体衍生的囊泡(大小为30~120 nm),形成于内体网络的囊泡体中。外泌体不仅参与肿瘤微环境中的细胞间交流,而且还参与供体和受体细胞之间的交流,在那里它们支持细胞因子、生长因子、血管生成素的分泌,并随后诱导受体细胞的增殖、侵袭和转移。肿瘤来源的外泌体含有广泛的成分,如脂质、蛋白质、DNA、mRNA和microRNAs(miRNAs)。实验证据表明miRNAs可以通过外泌体在细胞间转移。
最近的研究表明,miR-34c-3p促进胶质瘤细胞的生长,miR-34c-3p的减少使胶质瘤启动细胞保持自我更新特性,并产生抗凋亡作用。本文从NSCLC细胞中分离出外泌体,研究其在促进细胞迁移和侵袭中的作用,并进一步探讨其所含miRNAs(如miR-34c-3p)的功能及其参与的机制。
2. 结果展示
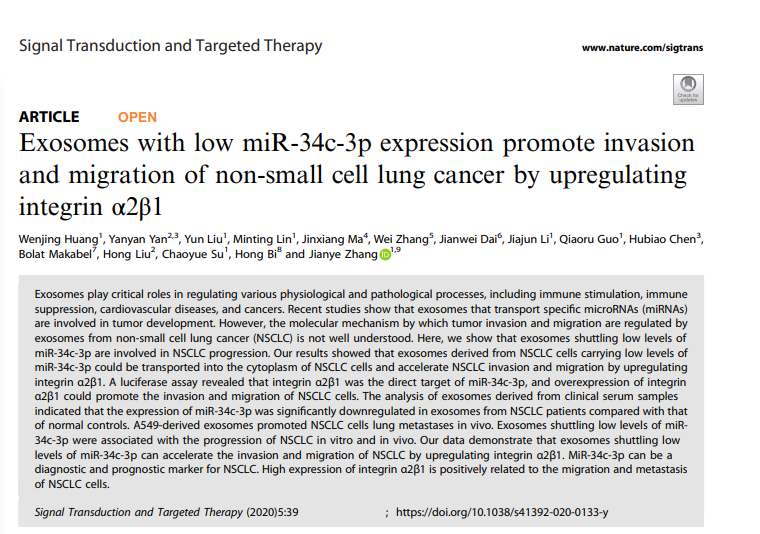
1)外泌体的特性和摄取。
我们首先从NSCLC细胞上清液中分离了外泌体并发现来自NSCLC细胞的外泌体是大小在30~120 nm之间的圆形小泡(图1a)。其次,我们发现外泌体中含有丰富的标记物CD9和CD63(图1b)。为了证实NSCLC细胞摄取外泌体的能力,将受体细胞与PKH-26标记的外泌体共同培养12h(×600,图1c)。结果表明,外泌体被摄取并转运到受体细胞的细胞质中。此外,电子显微镜证实外泌体制剂含有直径30~120 nm的圆形小泡(图1d)。这些结果表明,从NSCLC细胞中分离的外泌体具有足够的纯度,可以用于后续的实验。
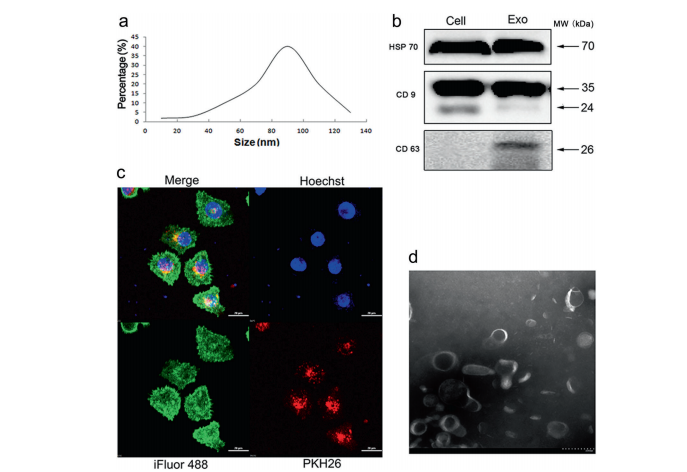
2)NSCLC细胞的外泌体诱导细胞侵袭和迁移。
为观察NSCLC来源的外泌体对A549和PC-9细胞增殖、侵袭和迁移的影响,分别以30和60μg/mL的外泌体蛋白处理A549和PC-9细胞,观察细胞增殖、侵袭和迁移的变化。结果表明,NSCLC外泌体以剂量和时间依赖的方式显著增加A549和PC-9细胞的侵袭和迁移(图2a,b表示迁移能力,2c和d表示侵袭能力)(图2,A549细胞,补充数据图)。PC-9细胞为S2)。另一方面,来自BEAS-2B细胞的外泌体抑制了A549细胞的迁移和侵袭(图2e,f)。以上结果提示,NSCLC细胞来源的外泌体可诱导A549细胞的迁移和侵袭。
3)NSCLC来源的外泌体的miRNA表达谱。
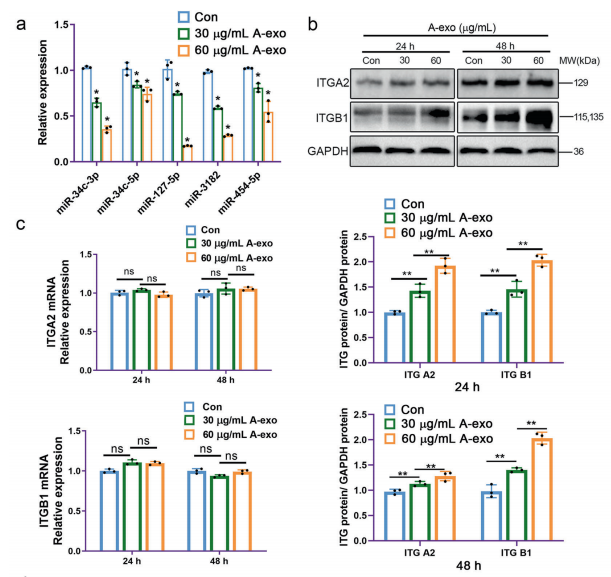
应用Illumina HiSeq2500高通量测序技术(miRNA-seq)研究NSCLC细胞外泌体的miRNA表达谱。我们发现在A549细胞和BEAS-2B细胞来源外泌体总RNA中,miRNAs的比例分别为10.97%和22.93%(图3a)。如图3b所示,我们在正常和NSCLC细胞外泌体中分别鉴定了平均761种和800种已知的miRNAs,其中,A549和BEAS-2B细胞来源的外泌体之间共享了8.36%的miRNAs。并且,BEAS-2B细胞外泌体与A549细胞的相关系数为0.828(图3c)。此外,我们还发现317条miRNAs在BEAS-2B细胞和A549细胞来源的外泌体之间存在显著差异(图3e)。为了验证miRNA测序结果,我们使用实时定量PCR检测了一些已鉴定的miRNAs的表达。A549细胞外泌体中miR-34c-3p、miR-34c-5p、miR127-5p、miR-889-3p、miR-3182和miR-454-5p的水平显著低于BEAS-2B细胞外泌体中的miR-34c-3p、miR-34c-5p、miR-34c-5p和miR-454-5p的水平(图3d)。

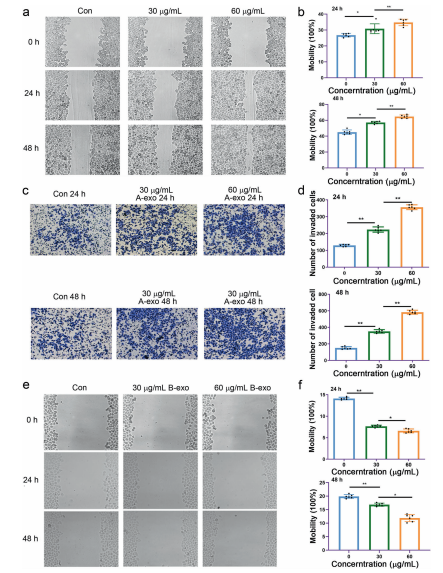
4)临床样本中外泌体miRNA和整合素α2β1的表达
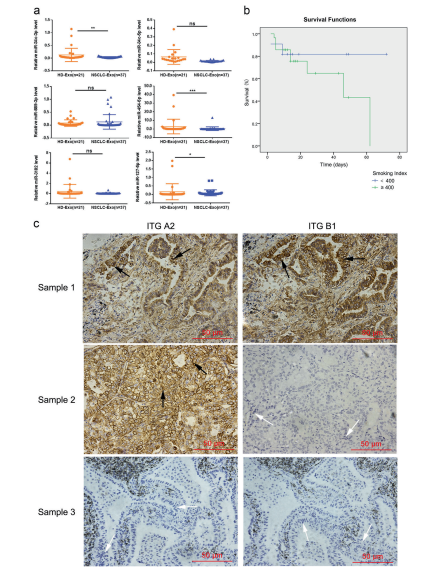
我们发现患者(n=37)血清外泌体miR-34c-3p水平明显低于健康对照组(n=21)。结合miRNA文库测序结果,我们得出结论:NSCLC患者外泌体miR-34c-3p、miR-454-5p和miR-127-5p的水平明显低于对照组(图4a)。此外,miR-34c-3p和miR-4545p水平与NSCLC的发病率存在潜在相关性(P=0.033和P=0.045)。图4b显示了NSCLC患者的Kaplan Meier曲线,该曲线发现重度吸烟导致NSCLC预后不良。众所周知,整合素的过度表达与肿瘤的发生和发展密切相关。在本研究中,我们发现人NSCLC组织中整合素β1表达增加,阳性表达率为38.0%。提示整合素α2β1在NSCLC中是一个重要的癌基因。
5)NSCLC细胞来源外泌体通过降低miR-34c-3p水平促进整合素α2β1的表达。
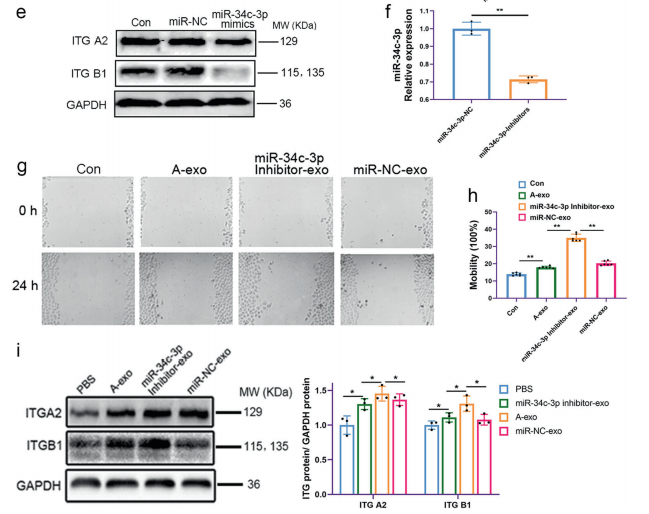
为了证实NSCLC外泌体在促进侵袭转移中的作用,我们检测了A549细胞经A549外泌体不同处理后miR-34c-3p和整合素α2β1的表达。与对照组相比,经不同浓度的NSCLC外泌体处理后,miR-34c-3p水平明显降低(图5a),整合素α2β1蛋白表达上调,尤其是在处理48h后(图5b)。然而,NSCLC外泌体的加入并不影响整合素α2β1mRNA的水平(图5c)。另外,利用TargetScan软件进行序列比对,确定了整合素α2(ITGA2)和整合素β1(ITGB1)mRNA 3‘-UTR中miR-34c-3p的潜在结合位点(图5e),表明miR-34c-3p可能调控ITGA2和ITGB1的表达。与ITGA2 3‘-UTR和mut 3’-UTR共转染的miR-34c-3p组Luc/R-Luc相对信号率分别为53.74±3.63%和81.03±8.68%。与ITGB1 3‘-UTR和mut 3’-UTR共转染的miR-34c-3p组Luc/R-Luc相对信号率分别为48.82±7.88%和85.28±6.78%。结果表明,在miR-34c-3p结合位点引入突变后,在miR34c-3p存在下的相对Luc/R-Luc信号被恢复(图5d)。免疫共沉淀的结果(图5f)反映了NSCLC细胞中整合素α2和β1之间的相互作用,这与预期不谋而合。

6)抑制miR-34c-3p上调整合素α2β1水平,促进肿瘤细胞迁移。
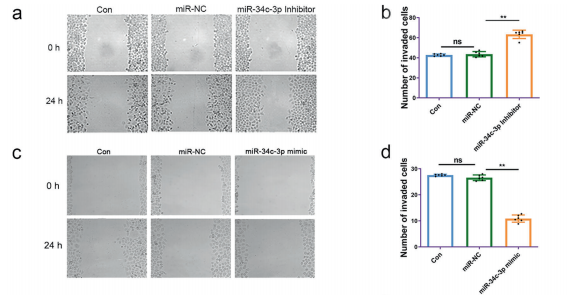
为了确定miR-34c3p的表达与肿瘤细胞迁移的关系,用miR-34c-3p模拟物或miR-34c-3p抑制剂(如方法所述)转染NSCLC细胞。给予miR-34c-3p抑制剂促进细胞迁移,而miR-34c-3p模拟物抑制NSCLC细胞的侵袭和迁移(图6a-d)。然后比较经miR-34c-3p抑制剂预处理的NSCLC外泌体与未处理的NSCLC外泌体在侵袭和转移方面的作用。将miR-34c-3p模拟物转染肿瘤细胞后,整合素α2β1的蛋白水平较miR-NC转染的肿瘤细胞降低(图6e)。转染miR-34c-3p抑制剂的A549细胞外泌体miR-34c-3p水平降低(图6f)。此外,与NSCLC外泌体处理相比,24小时后,miR-34c-3p抑制剂-外泌体处理显著促进了A549细胞的迁移(图6g,h)。与NSCLC外泌体注射后相比,给予miR-34c-3p抑制剂外泌体24小时后,整合素α2和β1的蛋白水平显著增加(图6i)。提示miR-34c-3p可能通过调节NSCLC细胞整合素α2β1的表达而参与调控肿瘤进展。
7)A549外泌体促进NSCLC细胞肺转移。
为了进一步研究A549外泌体在体内的作用,我们将A549细胞与A549衍生的外泌体在30μg/mL和60μg/mL浓度下孵育24 h,然后分别注射外泌体处理和未处理的A549细胞。经尾静脉注入BALB/c裸鼠。定期测量体重。接种7周后,处死小鼠,取肺进行转移和组织学评价。结果表明,外泌体治疗引起小鼠体重下降(P>0.05)(图7a)。重要的是,与注射未经处理的细胞后观察到的相比,注射体外培养的A549细胞的小鼠在肺部发展出更多或更大的转移结节,并且这种影响是剂量依赖性的(图7b,c)。肿瘤标本的H&E染色一致地表明,A549外泌体浓度越高,恶性转移的数量就越多(图7d)。随后应用免疫组化检测该蛋白ITGA2和ITGB1的表达。正如预期的那样,外泌体孵育组的转移瘤显示出比未处理组更高的ITGA2和ITGB1表达(图7e)。综上所述,体内转移实验证实,A549衍生的外泌体以剂量依赖的方式促进NSCLC细胞的体内转移,并与ITGA2和ITGB1的表达呈正相关。


3. 研究思路

4. 总结
综上所述,我们的研究阐明了外泌体中低水平的miR-34c-3p促进了NSCLC的进展。携带低水平miR-34c-3p的NSCLC外泌体转染受体细胞后,可增加整合素α2β1的水平,促进NSCLC细胞在体内外的侵袭和转移。因此,我们认为低水平的miR-34c-3p可能成为NSCLC患者临床治疗的潜在靶点和预后指标。整合素α2β1的高表达与NSCLC细胞的迁移转移呈正相关。
原文链接:https://pubmed.ncbi.nlm.nih.gov/32317629/ (Signal Transduct Target Ther, IF: 13.493)
特别鸣谢:
欢迎投稿:MLCMGD@163.com


