SCI论文解读(21):前列腺癌中p300乙酰化去甲基化酶JMJD1A抑制泛素化酶STUB1对其降解,增加其活性
发布单位: 广东省医学会医学科研实验室建设与管理学分会 / 阅读:3873 次 / 2021/10/25 8:36:51
 徐松辉,博士,广东省人民医院医学研究部。2016年毕业于暨南大学生命与健康工程研究院,获生物化学与分子生物学博士学位;2016年至2017年美国俄亥俄州立大学James Comprehensive Cancer Center,访问学者;2017年至2020美国马里兰大学医学院Marlene and Stewart Greenebaum Comprehensive Cancer Center,博士后 。目前课题组主要基于定量蛋白组学(SILAC)、单细胞组学和RNA-seq技术系统研究表观遗传调控子(组蛋白修饰酶、去修饰酶、泛素化修饰酶等)在肿瘤中的功能、机制以及临床研究;同时也致力于探寻基于组氨酸赖氨酸(HK)多肽核酸递送系统的开发病毒mRNA疫苗等。目前已发表20篇SCI论文,论文发表在Cancer Research、PNAS、Journal of Pathology、Transl Lung Cancer Res、Molecular Cancer Research等科学期刊。
徐松辉,博士,广东省人民医院医学研究部。2016年毕业于暨南大学生命与健康工程研究院,获生物化学与分子生物学博士学位;2016年至2017年美国俄亥俄州立大学James Comprehensive Cancer Center,访问学者;2017年至2020美国马里兰大学医学院Marlene and Stewart Greenebaum Comprehensive Cancer Center,博士后 。目前课题组主要基于定量蛋白组学(SILAC)、单细胞组学和RNA-seq技术系统研究表观遗传调控子(组蛋白修饰酶、去修饰酶、泛素化修饰酶等)在肿瘤中的功能、机制以及临床研究;同时也致力于探寻基于组氨酸赖氨酸(HK)多肽核酸递送系统的开发病毒mRNA疫苗等。目前已发表20篇SCI论文,论文发表在Cancer Research、PNAS、Journal of Pathology、Transl Lung Cancer Res、Molecular Cancer Research等科学期刊。

1. 引言
雄激素剥夺治疗是晚期前列腺癌主要的治疗方法,但是绝大多数患者经18至24个月的治疗后会出现耐药,发展为去势抵抗性前列腺癌(castration resistant prostate cancer, CRPC)。雄激素受体AR在去势抵抗性前列腺癌进展中发挥关键作用。前期我们的研究表明,在前列腺癌中去甲基化酶JMJD1A调节了AR以及c-Myc的转录活性。但是,JMJD1A在去势抵抗性前列腺癌中的功能与机理不清。
2. 结果展示
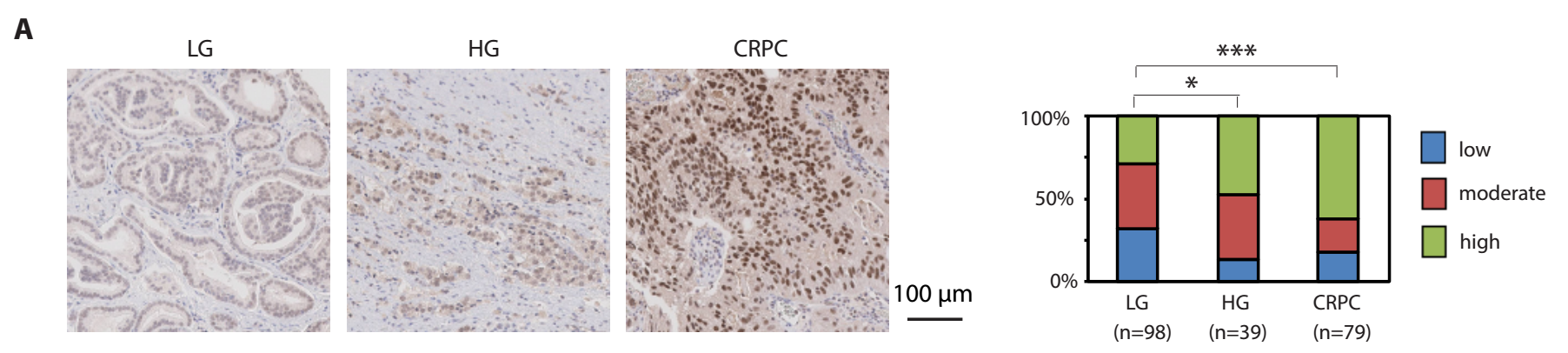
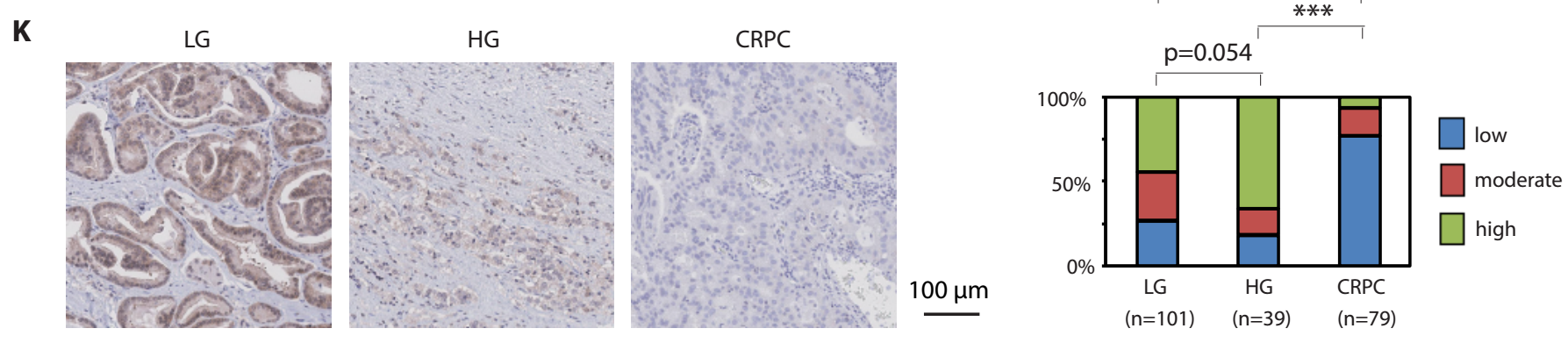
1)JMJD1A蛋白表达在去势抵抗性前列腺癌临床标本中上调(A)。STUB1蛋白表达在去势抵抗性前列腺癌临床标本中下调(K)。
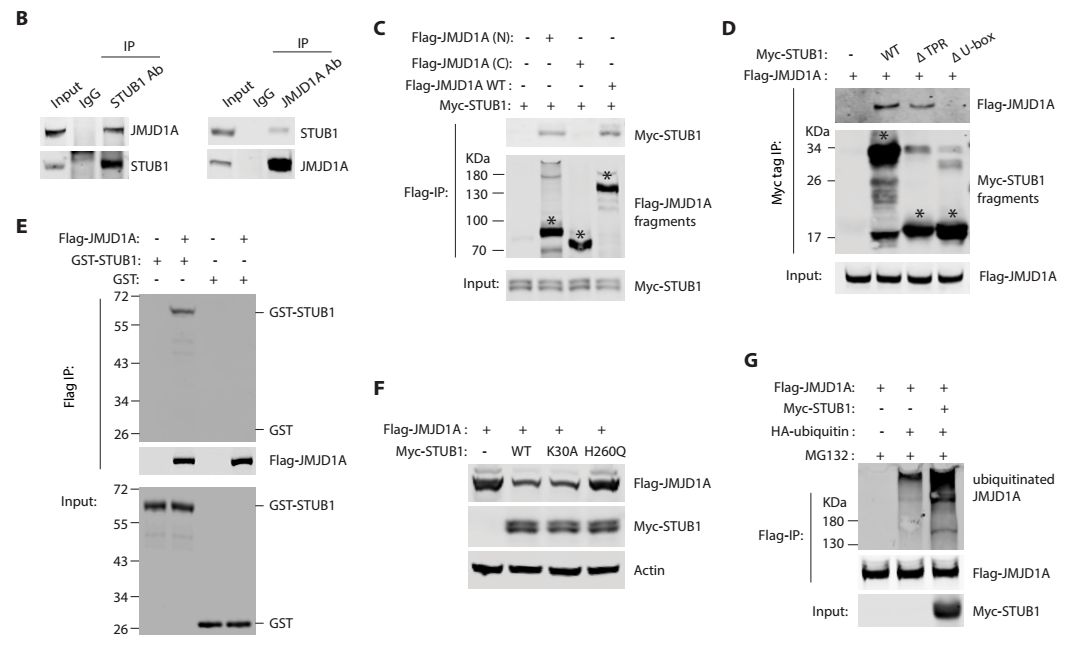
2)质谱分析发现,JMJD1A与STUB1存在蛋白相互作用。WB验证两者确实存在相互作用且鉴定两者相互作用结构域(B-D)。同时,泛素化酶STUB1直接泛素化JMJD1A(E-G)。
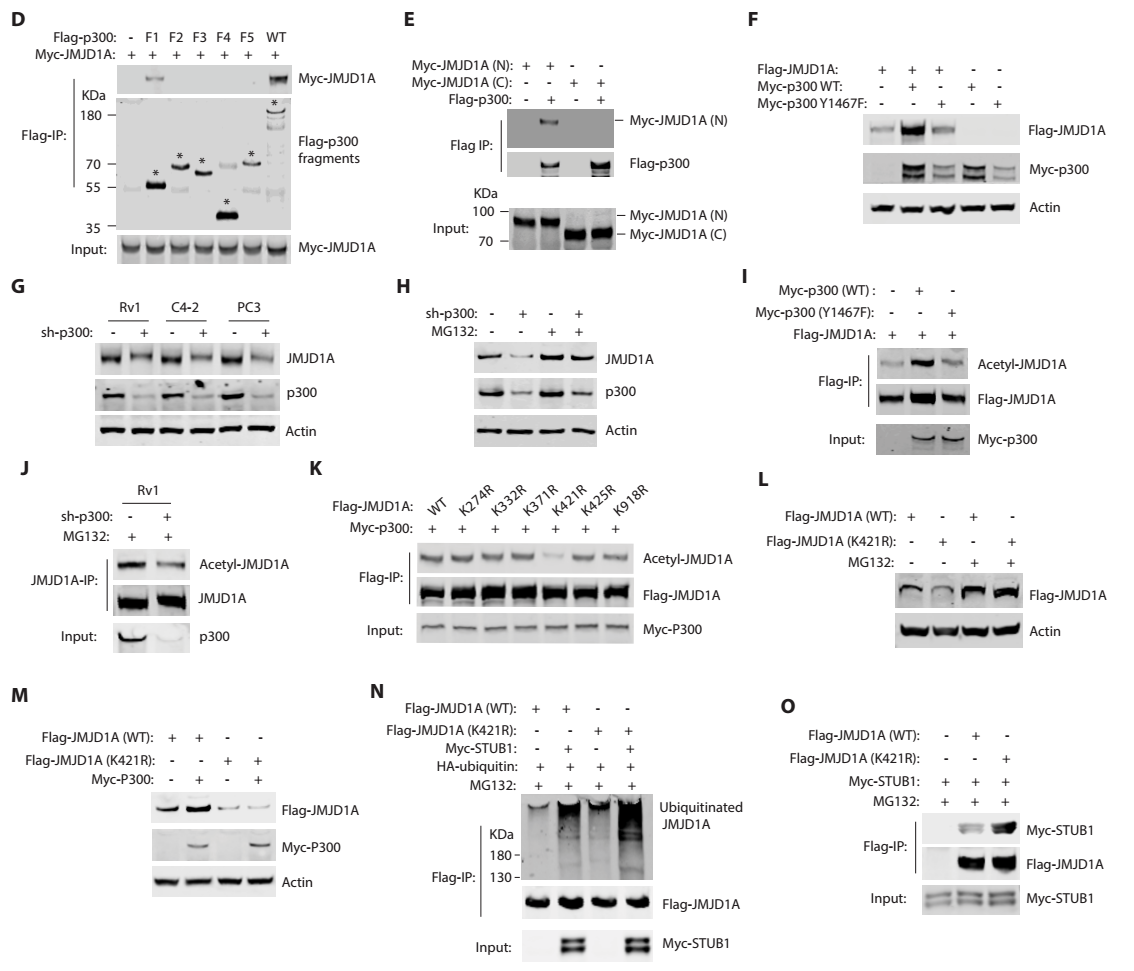
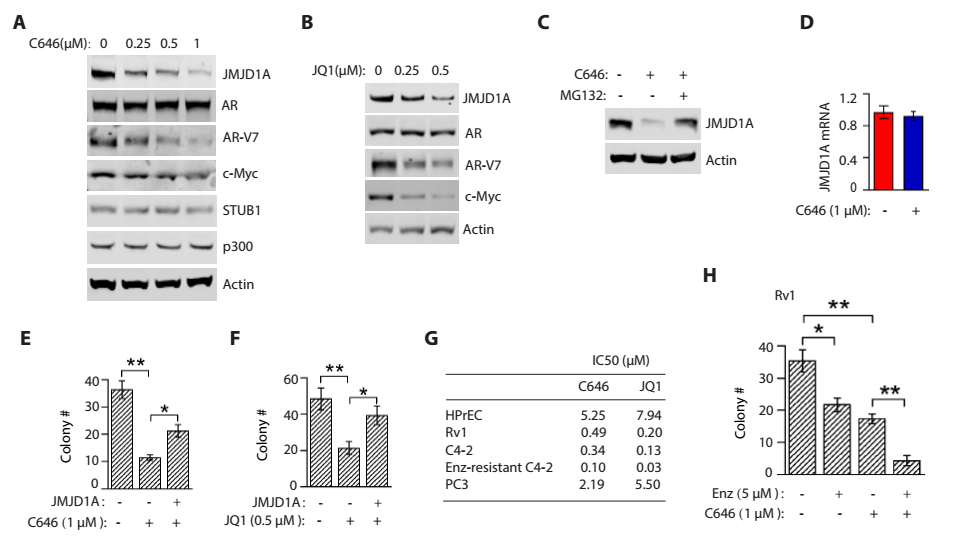
3)进一步发现p300使JMJD1A第421位赖氨酸发生乙酰化,这一位点的乙酰化抑制了泛素化酶STUB1对JMJD1A的降解。
4)前列腺癌耐药细胞系中p300活性的上调增加了JMJD1A的乙酰化,促进前列腺癌细胞系耐药。
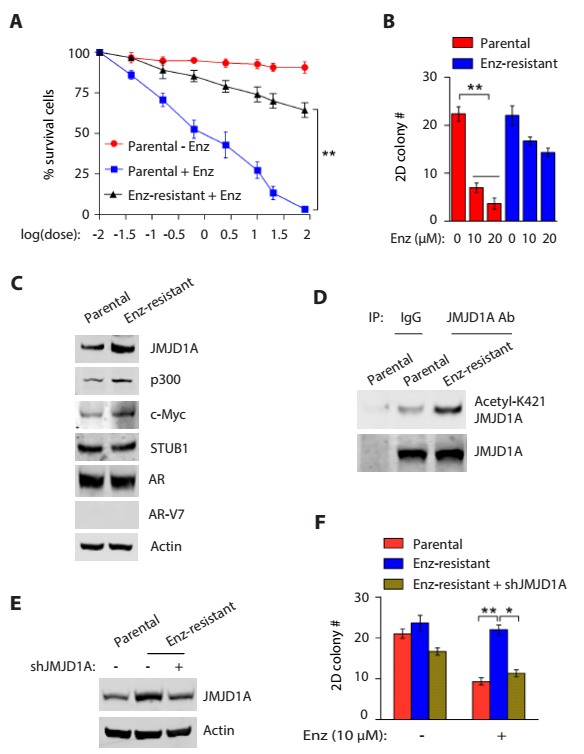
5)p300或者BRD抑制剂促进JMJD1A的降解,抑制了前列腺癌耐药细胞的增殖。
3. 研究思路

4. 总结
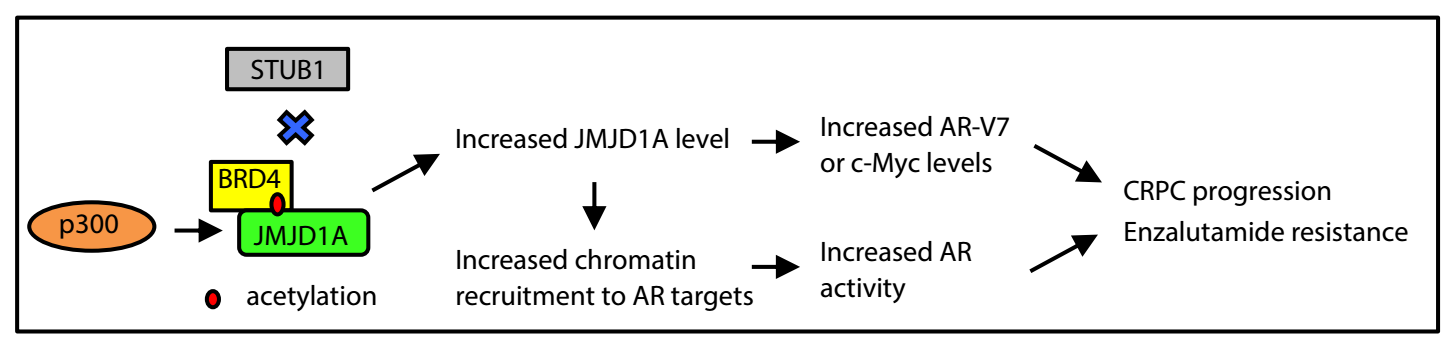
本研究发现p300活性的上调,增加了JMJD1A的乙酰化,抑制了泛素化酶STUB1对其降解,促进去势抵抗性前列腺癌的发展。采用p300或者BRD抑制剂可以促进JMJD1A降解,抑制前列腺癌耐药细胞的增殖。基于该调控机制的药物干预有望提高去势抵抗性前列腺癌耐药患者的生存期。
原文链接:https://cancerres.aacrjournals.org/content/80/15/3074.long (Cancer Research,IF=9.727)
特别鸣谢: 
本文转自:GD省医公共实验室公众号 
欢迎投稿:MLCMGD@163.com


