SCI论文解读(36):上尿路上皮癌类器官培养体系的建立及其在抗肿瘤药物筛选中的应用研究
发布单位: 广东省医学会医学科研实验室建设与管理学分会 / 阅读:6514 次 / 2022/12/28 8:14:15
 吴丁兰,南方医科大学深圳医院副研究员,临床医学创新中心副主任,博士后合作导师,深圳市海外高层次“孔雀计划”人才,香港中文大学博士、博士后,研究方向为核受体与肿瘤发生、抗肿瘤治疗靶点和肿瘤免疫微环境机制和转化医学研究。目前已发表SCI论文近30篇,第一作者或通讯作者论文发表在Journal for Immunotherapy of Cancer、Oncogene、J Pathology、BBA Reviews on Cancer等肿瘤学前沿杂志。主持国自然面上、深圳市科技计划学科布局重点项目等多项科研项目。学术任职包括中国研究型医院学会病毒肿瘤学专委会常委、秘书长,深圳市医学会实验医学专委会常委等。现为广东省医学会医学科研实验室建设与管理学分会青委会副主委。
吴丁兰,南方医科大学深圳医院副研究员,临床医学创新中心副主任,博士后合作导师,深圳市海外高层次“孔雀计划”人才,香港中文大学博士、博士后,研究方向为核受体与肿瘤发生、抗肿瘤治疗靶点和肿瘤免疫微环境机制和转化医学研究。目前已发表SCI论文近30篇,第一作者或通讯作者论文发表在Journal for Immunotherapy of Cancer、Oncogene、J Pathology、BBA Reviews on Cancer等肿瘤学前沿杂志。主持国自然面上、深圳市科技计划学科布局重点项目等多项科研项目。学术任职包括中国研究型医院学会病毒肿瘤学专委会常委、秘书长,深圳市医学会实验医学专委会常委等。现为广东省医学会医学科研实验室建设与管理学分会青委会副主委。

1. 引言
上尿路上皮癌(upper urinary tract urothelial carcinoma,UTUC)是位于肾盂和输尿管的特殊类型的尿路上皮癌。与膀胱尿路上皮癌相比,UTUC预后更差、复发转移率更高。化疗是其传统治疗手段,然而肿瘤异质性的存在使不同患者对化疗药物的敏感程度不同。个体化精准治疗是改善肿瘤患者预后的理想治疗手段,但针对UTUC的个体化精准医疗缺乏合适的临床前药物效果评价模型。
2021年12月17日,深圳市第二医院医学转化研究院黄卫人研究员联合北京大学第一医院在Advanced Science期刊 (IF=16.8) 在线发表了标题为Patient-derived Upper Tract Urothelial Carcinoma Organoids as a Platform for Drug Screening的研究成果。该研究首次建立了临床肿瘤组织来源的上尿路上皮癌类器官培养体系,极大地提高了上尿路上皮癌类器官建成的成功率。联合Single-cell RNA-seq技术,该研究证明肿瘤类器官可作为新型的肿瘤研究模型,针对耐药细胞开发新型肿瘤治疗策略。北京大学第一医院周利群教授、李学松教授以及深圳市第二人民医院黄卫人研究员为本文共同通讯作者,李志超博士、徐海波博士、巩艳青博士、陈巍博士以及詹永豪博士为本文共同第一作者。
2. 结果展示
1)建立临床肿瘤组织来源的上尿路上皮癌类器官培养体系。
首先,研究人员基于根治性肾输尿管切除术切除的组织样本,对维持类器官生长所通用的生长因子及信号通路调节剂进行了测试。结果表明,R-spondin1、noggin、SB202190等常用的类器官培养基添加剂对上尿路上皮癌类器官是非必需的;且EGF会显著降低肿瘤类器官培养的成功率,而EGF对于正常组织来源的类器官是必需的 (图1D)。通过对培养体系的优化,不仅使上尿路上皮癌类器官的培养效率得到极大提升 (图1A-C),同时解决了正常组织来源的类器官的污染问题 (图1D)。
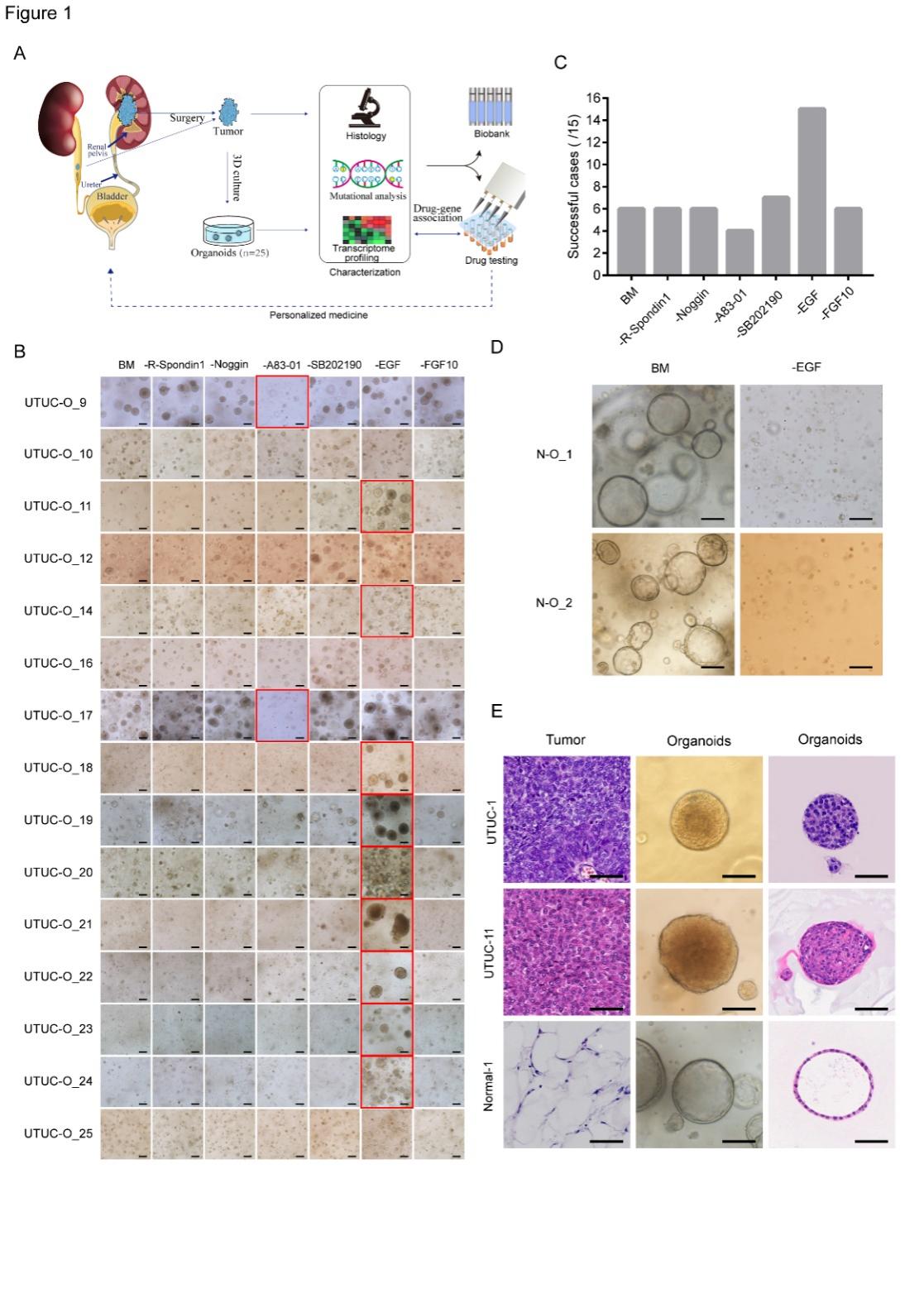
图1. 上尿路上皮癌类器官培养体系的建立
2)上尿路上皮癌类器官维持其来源肿瘤组织的特征。
为了验证培养的上尿路上皮癌可以精确维持其来源肿瘤组织的特征,本研究对培养的上尿路上皮癌类器官和其对应来源的肿瘤组织进行H&E染色、免疫荧光染色并将结果进行对比分析。研究结果表明,该体系建立的肿瘤类器官能够保持其来源肿瘤组织的病理形态结构以及表达的分子标志物 (图1E, 图2)。
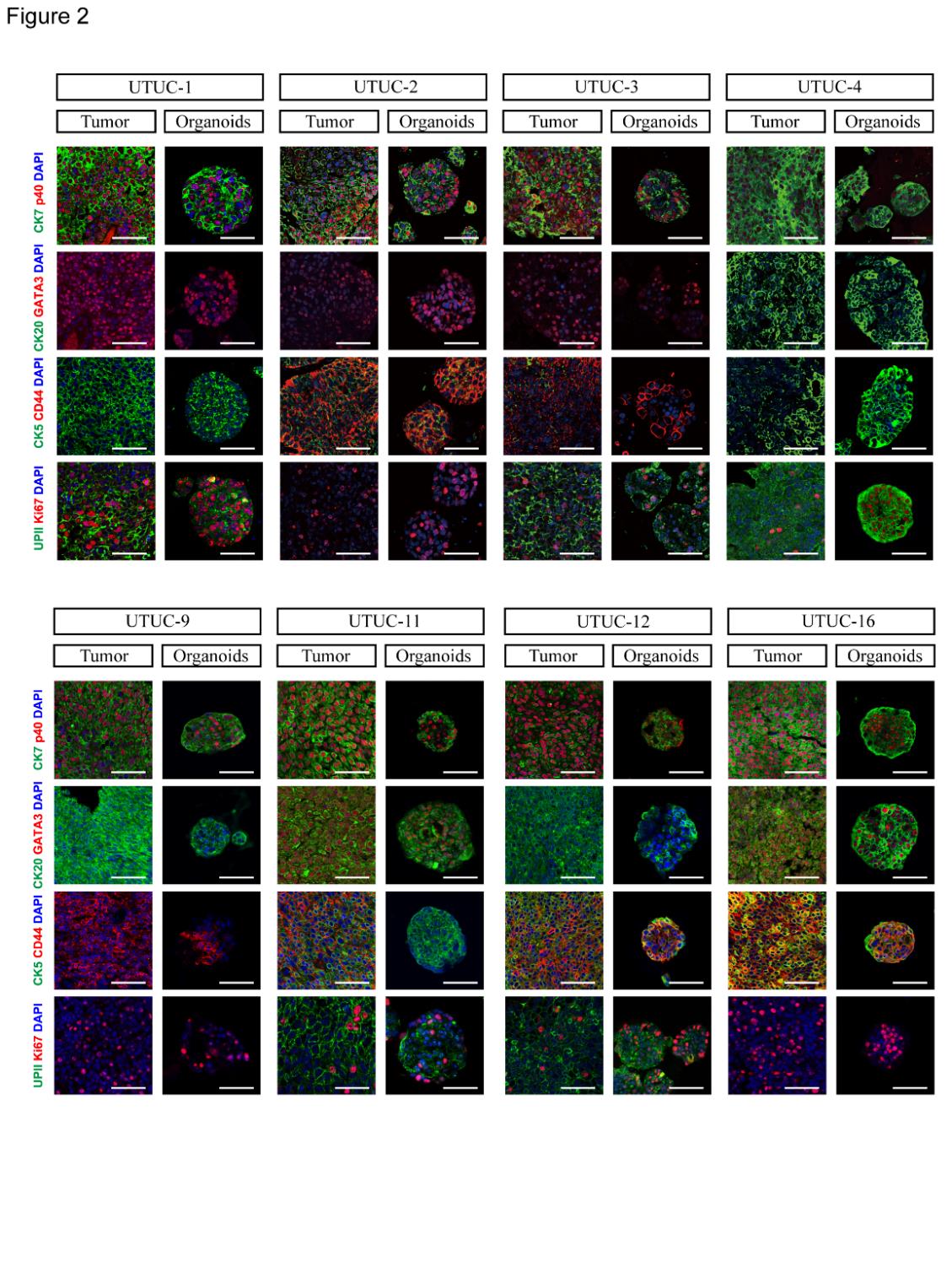
图2. 上尿路上皮癌类器官维持其来源肿瘤组织的分子标志物特征
全外显子测序分析结果表明,本研究培养的上尿路上皮癌所携带的UTUC常见基因突变 (图3A),碱基替换 (图3B)以及染色体拷贝数变异特征 (图3C)都与其来源肿瘤高度一致。
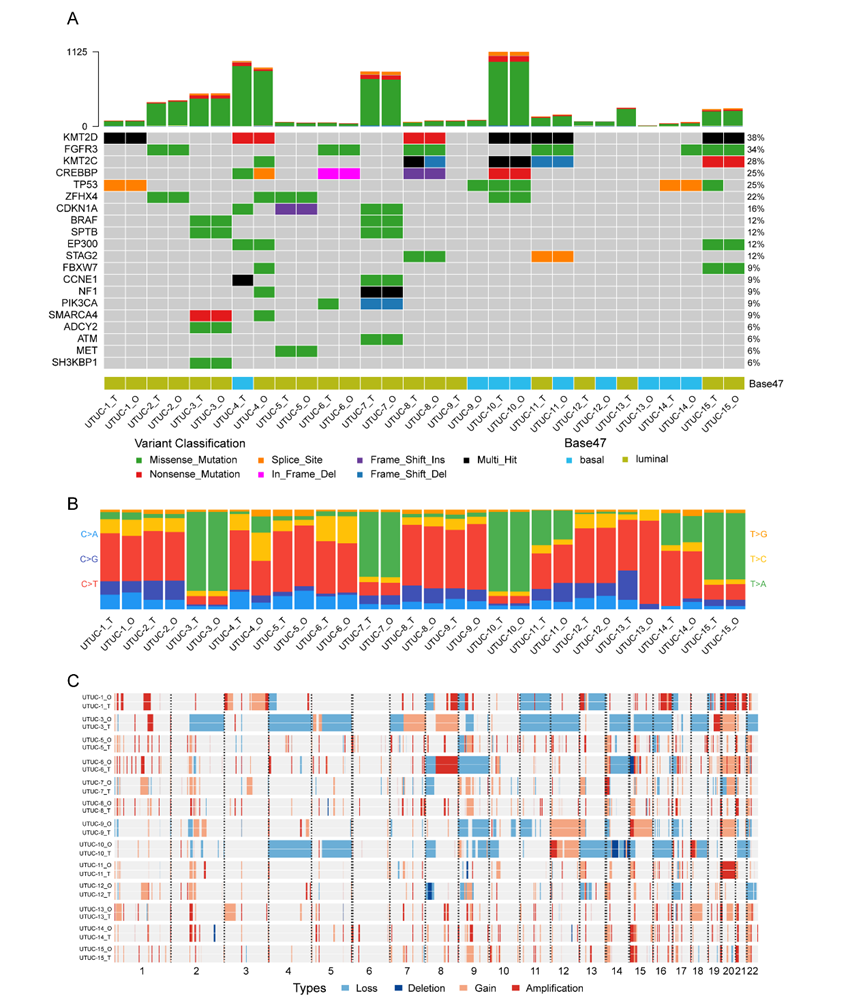
图3. 上尿路上皮癌类器官还原其来源肿瘤组织的基因突变特征
转录组测序结果表明,上尿路上皮癌类器官与其来源肿瘤组织在基因表达谱特征上基本一致 (图4A-D)。值得注意的是,部分肿瘤类器官的分子分型发生了luminal-basal的转换 (图4A),这有可能是由于目前常见的肿瘤类器官培养体系在体外缺少了肿瘤微环境 (如成纤维细胞等基质细胞)导致的。
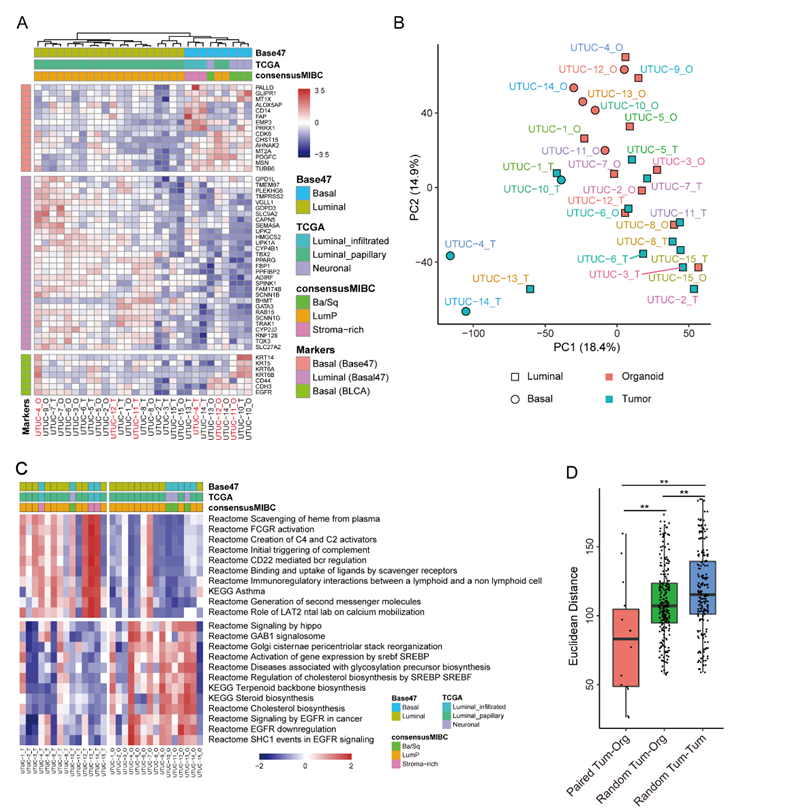
图4. 上尿路上皮癌类器官还原其来源肿瘤组织的基因表达谱特征
3)基于上尿路上皮癌类器官的抗肿瘤药物的筛选。
研究结果表明不同病人来源的肿瘤类器官对于抗肿瘤药物的敏感性存在巨大差异 (图5A-C),同时药物筛选结果具有稳定性及可重复性 (图5E)。FGFR3是上尿路上皮癌中常见的突变基因,基于肿瘤类器官的药物筛选结果表明,含有FGFR3激活突变的肿瘤类器官对Trametinib的敏感性显著高于FGFR3野生型的肿瘤类器官(图5D)。
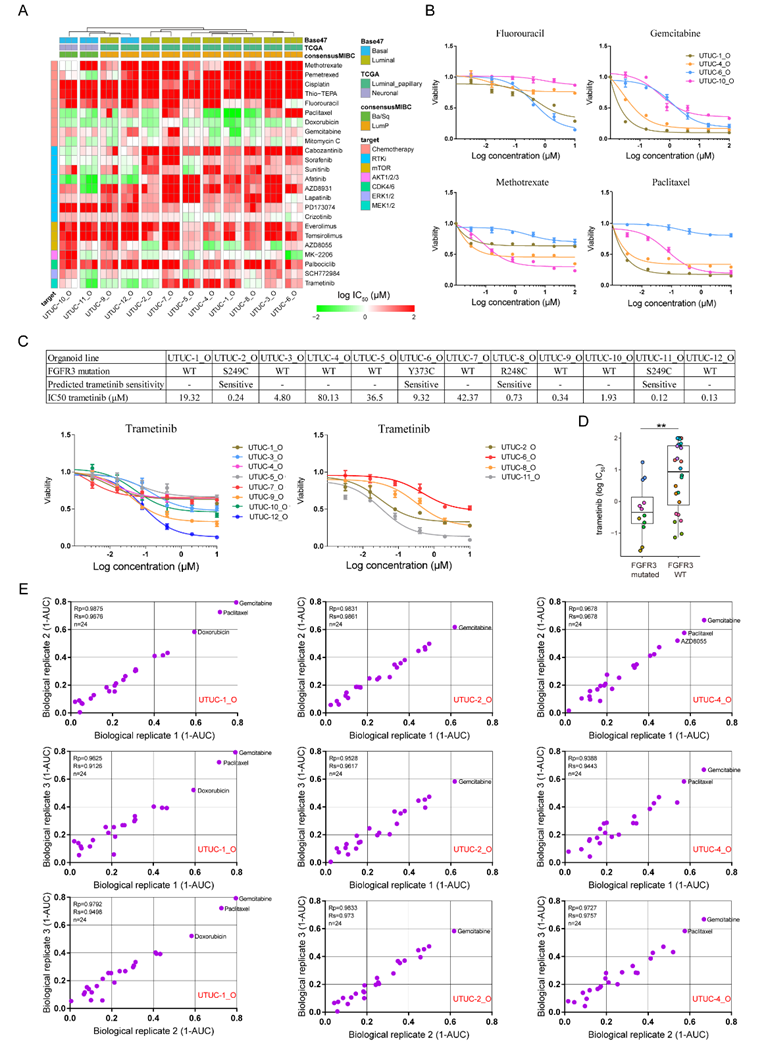
图5. 基于上尿路上皮癌类器官的抗肿瘤药物的筛选
4)基于肿瘤类器官模型探究肿瘤耐药机制及相应治疗策略。
基于肿瘤类器官的抗肿瘤药物处理及scRNA-seq结果表明,上尿路上皮癌类器官经过吉西他滨处理后产生了耐药性 (图6A-F),c-Met在吉西他滨处理后的耐药细胞中表达上升 (图6G),吉西他滨联合c-Met抑制剂卡博替尼可以有效逆转吉西他滨耐药从而杀伤肿瘤细胞 (图6H)。
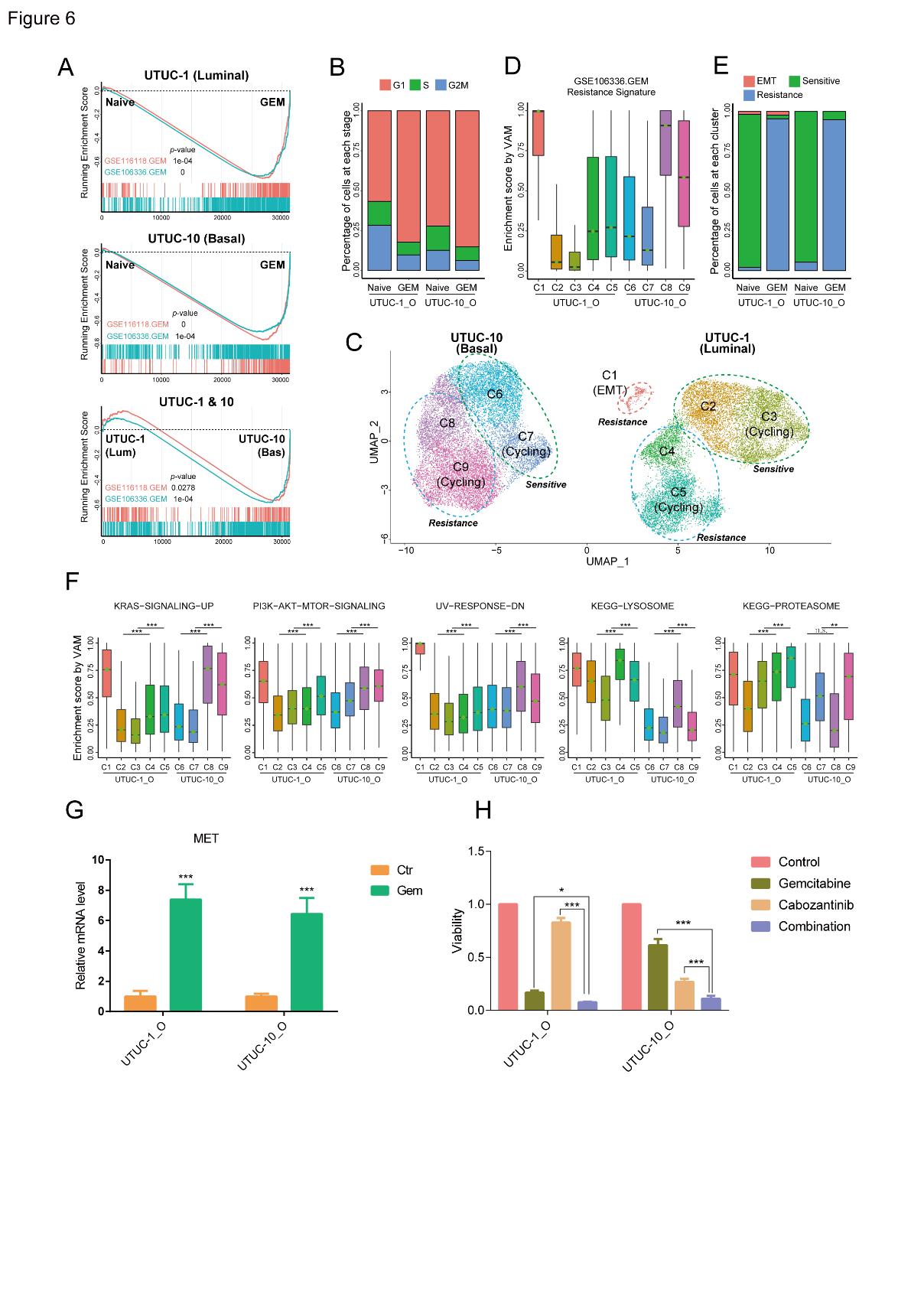
图6. 基于上尿路上皮癌类器官探究潜在治疗策略
3. 研究思路
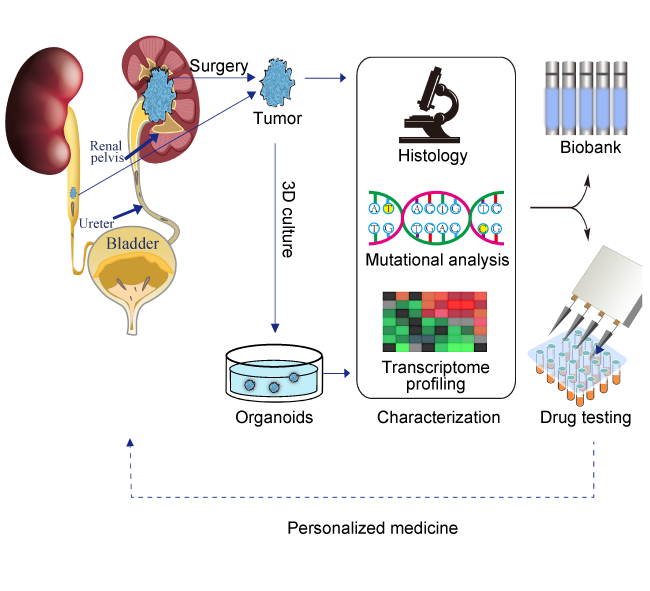
4. 总结
综上,该培养体系建立的肿瘤类器官不仅能够作为“肿瘤替身”进行临床前抗肿瘤药物的疗效预测,为上尿路上皮癌的个体化精准医疗提供理论依据,还可以联合使用单细胞测序技术,研究上尿路上皮癌耐药的分子机制及开发新型的治疗策略,有望为上尿路上皮癌发展有效的治疗策略提供理论和实验依据。
原文链接:https://doi.org/10.1002/advs.202103999 (Advanced science,IF=16.8)
文章通讯作者介绍:
黄卫人,深圳大学第一附属医院(深圳市第二人民医院)泌尿外科研究员,北京大学第一医院泌尿外科研究所研究员,国家重点研发计划项目首席科学家。国家地方联合肿瘤基因组临床应用关键技术工程实验室执行主任,广东省泌尿生殖肿瘤系统与合成生物学重点实验室副主任。主要从事泌尿系统肿瘤精准医学与合成生物学研究。相关成果获得中华医学科技奖项,广东省自然科学奖等奖励,获得发明专利授权11项。


